
����Ŀ���ش��������⣺
��1���������ʵ�����A��B�������2 L���ܱ������У��������·�Ӧ��3A(g) �� B(g) ![]() xC(g) ��2D(g),5min����c(D)��0.5mol��L��1��c(A)��c(B)��3��5��C�ķ�Ӧ������0.1mol��L��1��min��1��
xC(g) ��2D(g),5min����c(D)��0.5mol��L��1��c(A)��c(B)��3��5��C�ķ�Ӧ������0.1mol��L��1��min��1��
��A��5minĩ��Ũ����____________��
��v(B)��____________��
��x��____________��
��2����25��ʱ����100mL���Ȼ���14.6g��������Һ�У�����5.6g�����ۣ���Ӧ���е�2minĩ�ռ�������1.12 L(��״��)���ڴ˺��־���4min��������ȫ�ܽ⡣����������Һ����ı仯����
��ǰ2min����FeCl2��ʾ��ƽ����Ӧ������______________��
����4min����HCl��ʾ��ƽ����Ӧ������________________��
��ǰ2min���4min��ȣ���Ӧ����__________�Ͽ죬��ԭ����__________________��
���𰸡���1����0.75mol��L��1����0.05mol��L��1��min��1�� �� 2��
��2����0.25mol��(L��min)�� 1�� ��0.25mol��(L��min)������ǰ2min��ƽ����Ӧ���ʴ��ں�4min��ƽ����Ӧ���ʣ���������������ʱ������Ӧ���Ũ�ȣ���Ӧ�����������ŷ�Ӧ���У���Ӧ���Ũ����С�����v��֮��С��
��������
�����������1���� 3A(g)��B(g) ![]() xC(g)��2D(g)
xC(g)��2D(g)
��ʼ��Ũ�ȣ��� a a 0 0
���ģ�Ũ�ȣ��� 0.75 0.25 0.5
ƽ�⣨Ũ�ȣ���(a��0.75) (a��0.25) 0.5
����c(A)��c(B)=3��5�����a=1.5mol��L��1����˷�Ӧ��c(A)=(1.5��0.75)mol��L��1=0.75mol��L��1�������ݷ�Ӧ���ʵĶ��壬v(B)=0.25/5mol/(L��min)=0.05 mol/(L��min)�������ݻ�ѧ����֮�ȵ��ڻ�ѧ������֮�ȣ�x=2����2����Fe��2HCl=FeCl2��H2����n(FeCl2)=n(H2)=1.12/22.4mol=0.05mol��v(FeCl2)=0.05/(2��100��10��3)mol/(L��min)=0.25 mol/(L��min)����ǰ2min���ĵ�Fe�����ʵ���Ϊ1.12/22.4mol=0.05mol����4min����n(HCl)=2����5.6/56��0.05��mol=0.1mol��v(HCl)=0.1/(4��100��10��3) mol/(L��min)=0.25 mol/(L��min)���������������䣬���ŷ�Ӧ�Ľ��������Ũ�Ƚ��ͣ���Ӧ���ʼ�����ǰ2min��ƽ����Ӧ���ʴ��ں�4min��ƽ����Ӧ���ʡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���ʵ��������������ó��Ľ�����ȷ����
ѡ�� | ʵ����� | ʵ������ | ���� |
A | ��ij������Һ�еμ�ϡ���� | ������ʹʯ��ˮ����ǵ����� | ����Һһ������CO��HCO |
B | KIO3��Һ�м���HI��Һ����������� | ��Һ����ɫ | KIO3�������Ա�I2ǿ |
C | ��Na2S��Һ�еμ����� | ������������ζ������ | �ȵķǽ����Ա����ǿ |
D | CO��ԭFe2O3�õ��ĺ�ɫ������������ܽ���ټ���KSCN��Һ | ��Һ���Ժ�ɫ | ��ɫ��������Fe3O4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ���������c(H+)��c(OH-)�ij˻�Ϊ1��10-18����Һ����ܴ��������������( )
A. NH4+��Na+��Cl-��I- B. Na+��K+��Fe3+��SCN-
C. Na+��Al3+��Cl-��AlO2- D. Na+��K+��Cl-��HCO3-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A~H��Ϊ������Ԫ�أ�A~F��Ԫ�����ڱ��е����λ������ͼ��ʾ��G����������Ԫ�ز���ͬһ���ڣ�H�Ƕ�������ԭ�Ӱ뾶��������Ԫ�ء���B��G��ɵ���̬�������ˮ��Һ�ʼ��ԡ�
A | B | C | |
D | E | F |
��ش��������⣺
��1��д���ĵ���ʽ��ʵ������ȡ����Ļ�ѧ����ʽΪ��
��2��B��C��G������Ϊ1:1:5�γɵĻ�����Ļ�ѧ������Ϊ��
A�����Ӽ�
B�����Լ�
C���Ǽ��Լ�
��3�����õ���ʽ��ʾAE2���γɹ��̡�
��4�������ӷ��ű�ʾC��E��F��H�������ӵİ뾶�ɴ�С��˳��
��5����һ�����ӷ���ʽ����A��D�ǽ�����ǿ��ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ˮ�ۺ����õĹ�ҵ����ͼ���ж�����˵����ȷ����
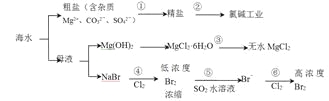
��֪��MgCl2��6H2O��������Mg��OH��Cl��HCl����ȡ�
A. ���������ᴿ���������̣�������ͨ��������ԭ��Ӧ�ɲ���2�ֵ���
B. �ڹ������н�MgCl2��6H2O���ռ����Ƶ���ˮMgCl2
C. ��������Ӧ����Һ��ǿ���ԣ���������������豸�ĸ�ʴ����
D. �ڹ�����������Ӧ��ÿ����0��2molBr��������2��24LCl2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ���������ճ�������������Ҫ��Ӧ�á�����˵������ȷ����( )
A����ҵ�ϵ������Al2O3�Ʊ�������
B���ں������������п�飬�ɼ�������ĸ�ʴ����
C������п��ϡ���ᷴӦ��ȡ��������п�ȴ�п��Ӧ���ʿ�
D�����MgCl2������Һ�����Ƶý���þ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͭ����������ʹ�õĽ���֮һ�����й���ͭ�缫����������ȷ����( )
A��ͭпԭ�����ͭ������
B���õ�ⷨ������ͭʱ��ͭ������
C���ڶƼ��϶�ͭʱ���ý���ͭ������
D�����ˮ��H2��O2ʱͭ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��п�̵�أ��׳Ƹɵ�أ��������е������ܴ�������ͨп�̵�صĹ���ͼ����ͼ��ʾ���ش��������⣺
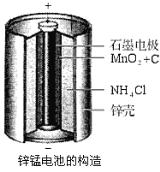
��1����طŵ�ʱ��������Ҫ��ӦΪ��
Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnOOH��������������Ҫ��Ӧ��________________________��
��2����ͼ��ʾ�ӷϾ���ͨп�̵�س�ȥп�Ǻ͵缫����������������Ʊ�KMnO4�����ʵ�һ�ֹ��գ������ǷϾɵ����ʵ�ʴ��ڵ�����������������
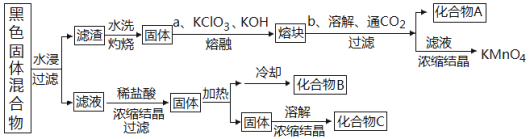
����ɫ��������ˮ��ʱΪ��߽������ʣ������õĴ�ʩΪ________________�������������õ���Һ����ϡ���������Ϊ__________________��
������ˮϴ���պ������Ҫ�ɷ�ֻ��һ�֣�����a�еõ��ۿ����Ҫ�ɷ���K2MnO4���ù�����������Ӧ�Ļ�ѧ����ʽΪ��_____________________________��
��ͼ�в���Ļ�ѧʽ�ֱ�Ϊ��A__________��B_________��
��3��ȷ�����õ���KMnO4������������ᷴӦ�����ʣ�3.160 g������С�ձ��У���ˮ�ܽ��ת�Ƶ�200mL����ƿ�ж��ݣ�����ƿ���ò�������ȡ0.6700 g��ˮ����������������������Һ�ܽ⣬������75~80�����������ƺõ�KMnO4��Һ���еζ���������Һ���Ϊ22.50mL��
��֪Mr(Na2C2O4)=134 Mr(KMnO4)=158
���жϵζ��յ��������__________________��
��KMnO4�Ĵ���Ϊ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����¯���������з�������Ҫ��ӦΪ��1/3Fe2O3(s)+ CO(g) ![]() 2/3Fe(s)+CO2(g)
2/3Fe(s)+CO2(g)
��֪�÷�Ӧ�ڲ�ͬ�¶��µ�ƽ�ⳣ�����£�

��ش��������⣺
��1���÷�Ӧ��ƽ�ⳣ������ʽK=__________����H______0(�>������<����=��)��
��2����һ���ݻ�Ϊ10L���ܱ������У�1000��ʱ����Fe��Fe2O3��CO��CO2��1.0 mol����Ӧ����l0 min��ﵽƽ�⡣���ʱ�䷶Χ�ڷ�Ӧ��ƽ����Ӧ���ʦ�(CO2)= _____________��CO��ƽ��ת����= _____________��
��3���������2����CO��ƽ��ת���ʣ��ɲ�ȡ�Ĵ�ʩ��_____________��
A����Fe���� B����Fe2O3���� C�Ƴ�����CO2
D��߷�Ӧ�¶� E��С�������ݻ� F������ʵĴ���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com