
ǿ����ǿ���ϡ��Һ�����кͷ�Ӧ����ЧӦΪ��H����aq����OH����aq����H2O ��l�� ��H����57.3 KJ��mol��1���ֱ���1L 0.5mol��L��1��Ba��OH��2����Һ�м����Ũ�����ϡ�����ϡ���ᣬǡ����ȫ��Ӧ����ЧӦ�ֱ�Ϊ��H1����H2����H3�����й�ϵ��ȷ����
A����H1����H2����H3 B����H1����H2����H3
C����H1����H2����H3 D����H1����H2����H3
 ����С��ʿ���������ϵ�д�
����С��ʿ���������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ������ʡ�߶��ϵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
�����£�����ͬŨ�ȵ�NaOH��Һ���ֱ�ζ�100mLŨ�Ⱦ�Ϊ0��1mol��L��1�������ᣨHM��HN��HR����Һ���ζ���������ͼ��ʾ�������жϴ������ �� ��
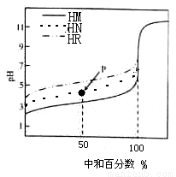
A��������ĵ��볣����ϵ��KHM��KHN��KHR
B��pH=7ʱ��������Һ�У�c��M������c��N������c��R����
C���ζ���P��ʱ����Һ�У�c��Na������ c��N������c��HN����c��H������c��OH����
D�����кͰٷ�����100%ʱ����������Һ��Ϻ� c��HM����c��HN����c��HR��=c(OH��)��c��H����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�����ʡ��һ�ϵ�һ��ѧ�ο��Ի�ѧ���������棩 ���ͣ������
��1��49g��������ʵ����� �������� ��������ԭ������ ����
��2��34g������ gˮ������ͬ��Ŀ����ԭ�ӣ�
��3����״����33.6L������������ ,���������ͬ�ļ�������ʵ����� ��
��4����Ҫ����200ml 0.5mol•L-1CuSO4��Һ����Ҫ��ȡ g CuSO4���壬���ȡ g CuSO4•5H2O���塣
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�갲��ʡ�߶��ϵ�һ���¿���ѧ�Ծ��������棩 ���ͣ������
�״�����Ҫ�Ļ�ѧ��ҵ����ԭ�Ϻ�Һ��ȼ�ϡ���ҵ�Ͽ�����CO��CO2������ȼ�ϼ״�����֪�״��Ʊ����йػ�ѧ��Ӧ�Լ��ڲ�ͬ�¶��µĻ�ѧ��Ӧƽ�ⳣ�����±���ʾ��
��ѧ��Ӧ | ƽ�ⳣ�� | �¶ȣ��棩 | |
500 | 800 | ||
��2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
��H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
��3H2(g)+ CO2(g) | K3 | ||
��1����Ӧ���� ������ȡ����ȡ�����Ӧ��
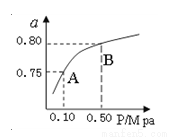
��2��ij�¶��·�Ӧ����H2��ƽ��ת���ʣ�a������ϵ��ѹǿ(P)�Ĺ�ϵ��ͼ��ʾ����ƽ��״̬��A�䵽Bʱ��ƽ�ⳣ��K(A) K(B)�����������������=������
��3��500�� K3= ����Ӧ�ۡ�H 0���>����=����<����
��500�桢2L���ܱ������У����з�Ӧ�ۣ����ijʱ��H2��CO2�� CH3OH��H2O�����ʵ����ֱ�Ϊ6mol��2 mol��10 mol��10 mol����ʱv(��) v(��) ���>����=����<����
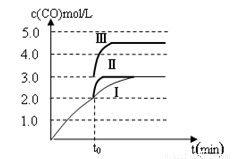
��4��һ���¶��£���3 L�ݻ��ɱ���ܱ������з�����Ӧ�ڣ���֪c(CO)�뷴Ӧʱ��t�仯���ߢ���ͼ��ʾ������t0ʱ�̷ֱ�ı�һ�����������ߢ��Ϊ���ߢ�����ߢ����ߢ��Ϊ���ߢ�ʱ���ı�������� �������ߢ��Ϊ���ߢ�ʱ���ı�������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�갲��ʡ�߶��ϵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
���ܱ������н��з�ӦCH4(g)��H2O(g) CO(g)��3H2(g) ��H��0�����c(CH4)�淴Ӧʱ��(t)�ı仯��ͼ��ʾ�������ж���ȷ����
CO(g)��3H2(g) ��H��0�����c(CH4)�淴Ӧʱ��(t)�ı仯��ͼ��ʾ�������ж���ȷ����

A��0~5 min�ڣ�v(H2)��0.1 mol��(L��min)��1
B����Ӧ���е�12minʱ��CH4��ת����Ϊ25%
C�������£���С���������ƽ���H2Ũ�ȼ�С
D��10 minʱ���ı��������������������¶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�갲��ʡ�߶��ϵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
�����Ȼ�ѧ����ʽ����ȷ���ǣ� ��
A��4g��������ȫȼ������SO2���ų�37 kJ������S(s)+O2(g)=SO2(g) ��H= -296kJ/mol
B��1molN2��3molH2��ij�ܱ������з�Ӧ�ų�73kJ��������Ӧ���Ȼ�ѧ����ʽΪ��N2(g)+3H2(g) 2NH3(g) ��H=-73kJ/mol
2NH3(g) ��H=-73kJ/mol
C������ı�ȼ����Ϊ-890.3kJ��mol-1�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ��CH4(g)+2O2(g)��CO2(g)+ 2H2O(g) ��H=-890.3kJ��mol-1
D��ǿ��ǿ����к���Ϊ-57.3 kJ/mol�� Ba(OH)2(aq)+H2SO4(aq)��BaSO4(S)+2H2O(l) ��H=-114.6kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�콭��ʡ��ͨ���綫�������з��ظ���10��������ѧ���������棩 ���ͣ��ƶ���
��ͼ��һЩ�����ĵ��ʡ�������֮���ת����ϵͼ����Щ��Ӧ�еIJ������ʱ���ȥ����Ӧ�ٳ���Ӧ����Ұ�⺸�Ӹֹ죬F�Ǻ�ˮ�к����ε���Ҫ�ɷ֣�JΪD��G��Ӧ�����γɵ�ˮ��Һ��
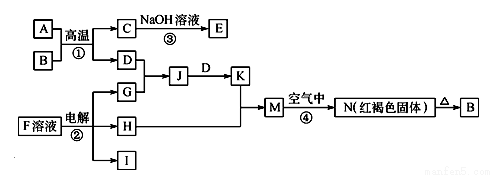
��ش��������⣺
��1��B�Ļ�ѧʽΪ ��
��2��H�ĵ���ʽΪ ��
��3��д����Ӧ�ڵ����ӷ���ʽ ��
��4��д����Ӧ�ܵĻ�ѧ����ʽ ��
��5��D��ĿǰӦ����㷺�Ľ�����D��̿�������ˮ��Һ�п��γ�������ء�������Cr2O72�C�����Է�ˮͨ���û�������� ����Cr2O72�Cת��ΪCr3������缫��ӦʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�����ʡ�������Ͽ��Ի�ѧ�Ծ��������棩 ���ͣ������
������ҵ�г��ô���ͭ����Һ{��[Cu(NH3)2]+��CH3COO����NH3}��ȥH2�е�CO��O2��H2S���塣
��1����֪����ͭ����Һ����CO�ķ�ӦΪ��
[Cu(NH3)2]+(aq)+CO(g)+NH3(g)  [Cu(NH3)3��CO]+(aq)
[Cu(NH3)3��CO]+(aq)
����Ӧ�ں����ܱ������н��У�����˵���÷�Ӧ�Ѵﵽƽ��״̬���� ��
a��v(CO)��=v(NH3)��
b������������ѹǿ������ʱ��仯
c��[Cu(NH3)2]+Ũ�Ȳ�����ʱ��仯
��2������ͭ����Һ����COһ��ʱ���ʧЧ�������з����ɻ��շϴ���ͭ����Һ�е�ͭ��
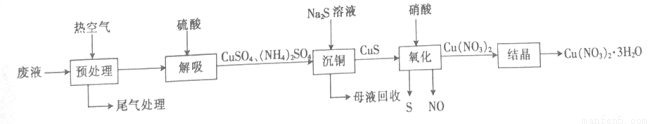
��Ԥ������ʱ��β���г�N2��CO��O2��CO2��H2O�⣬���� ��
�ڼ���������Һʱ������Ӧ�����ӷ���ʽΪ ��
�ۼ�������ʱ������Ӧ�Ļ�ѧ����ʽΪ ��
����֪����������ֻ�С���ͭ���͡��ᾧ������ͭԪ������ġ�����ͭ��ʱͭԪ�ص������Ϊ4%�����ᾧ��ʱͭԪ�ص������Ϊ2%����1L��Һ�����Ƶ�Cu(NO3)2��3H2O 363g����1L��Һ��ͭԪ�ص�����Ϊ g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 �����£�a mol A��b mol B����ͼ��ʾ���������ɻ����������з������·�Ӧ��A��g��+2B��g��?2C��g����һ��ʱ���ﵽƽ�⣬����n mol C��������˵������ȷ���ǣ�������
�����£�a mol A��b mol B����ͼ��ʾ���������ɻ����������з������·�Ӧ��A��g��+2B��g��?2C��g����һ��ʱ���ﵽƽ�⣬����n mol C��������˵������ȷ���ǣ�������| A�� | ����A��B��ת����֮��Ϊa��b | |
| B�� | ��ʼʱ�̺ʹ�ƽ��������е�ѹǿ��Ϊ��a+b������a+b-$\frac{n}{2}$�� | |
| C�� | ����ʼʱ����2a mol A��2b mol B�����ƽ��ʱ����2n mol C | |
| D�� | ��v����A��=2v����B��ʱ�����ж���Ӧ�ﵽƽ�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com