
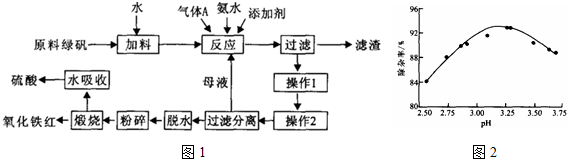
���� ԭ���̷��У���Ҫ�ɷ����̷�������TiO2���ؽ������ӣ�����ˮ�ܽ����ð�ˮ����PHֵ���ٽ��ؽ�������ˮ�⣬�Ա������ȥ����ȥ���ʣ����˺������������Һ����Һ����Ũ������ȴ�ᾧ�����˵������������壬��Һ��ѭ�����ã����������������յ�����������������
��1��ԭ���̷��������������ױ������������ӣ���Ҫ�������۽���Ԥ������
��2�������е���������������������Һ�е��������ӣ�����Ҫ�õ�����������������ͼ��pH������ʵĹ�ϵ����ȷ��PHֵ��
��3��������������Һ�л�������������壬�����ü���Ũ������ȴ�ᾧ������þ��壻
��4���̷�ͨ����ˮ�����յȹ���ת��Ϊ��������Ĺ�����FeSO4•7H2O����FeSO4•H2O��FeSO4•H2O�ٱ�������������������������Ԫ���غ��Ԫ���غ���д��ѧ����ʽ��
��5���������̷�����֪ѭ�������ʣ�
��6��������Ԫ���غ�ɼ������������IJ�����
��7�����ݷ�Ӧ ��i��TiO2��g��+2C12��g���TTiC14��1��+O2��g����H=+141kJ•mol-1����ii��TiO2��g��+C��s��+2C12��g���TTiC14��1��+CO2��g����H=-218kJ•mol-1��֪����i����Ӧ�����ȡ��ؼ���Ӧ����ii���Ƿ��ȡ�������Ӧ��Mg�ڸ����»�ԭTiC14�������Ȼ�þ���ѣ��ݴ˴��⣮
��� �⣺ԭ���̷��У���Ҫ�ɷ����̷�������TiO2���ؽ������ӣ�����ˮ�ܽ����ð�ˮ����PHֵ���ٽ��ؽ�������ˮ�⣬�Ա������ȥ����ȥ���ʣ����˺������������Һ����Һ����Ũ������ȴ�ᾧ�����˵������������壬��Һ��ѭ�����ã����������������յ�����������������
��1��ԭ���̷��������������ױ������������ӣ���Ҫ�������۽���Ԥ��������Ӧ�����ӷ���ʽΪFe+2Fe3+=3Fe2+��
�ʴ�Ϊ��Fe+2Fe3+=3Fe2+��
��2�������е���������������������Һ�е��������ӣ�����Ҫ�õ���������������������AΪN2������ͼ��pH������ʵĹ�ϵ����֪PHֵΪ3.2-4.4֮���������ߣ����Ե���pH���˷�ΧΪ��
�ʴ�Ϊ��N2��3.2-4.4��
��3��������������Һ�л�������������壬�����ü���Ũ������ȴ�ᾧ������þ��壬
�ʴ�Ϊ������Ũ������ȴ�ᾧ��
��4���̷�ͨ����ˮ�����յȹ���ת��Ϊ��������Ĺ�����FeSO4•7H2O����FeSO4•H2O��FeSO4•H2O�ٱ�����������������������Ӧ�Ļ�ѧ����ʽΪ4FeSO4•H2O+O2$\frac{\underline{\;\;��\;\;}}{\;}$2Fe2O3+4SO3��+4H2O����
�ʴ�Ϊ��4FeSO4•H2O+O2$\frac{\underline{\;\;��\;\;}}{\;}$2Fe2O3+4SO3��+4H2O����
��5���������̷�����֪ѭ��������Ϊ FeSO4��
�ʴ�Ϊ��FeSO4��
��6��3t����Ϊ96.5%���̷�ԭ����FeSO4•7H2O������Ϊ2895kg�����Ժ���Ԫ�ص�����Ϊ2895kg��$\frac{56}{278}$��100%=583.2kg��������Ԫ���غ��֪������������Ϊ$\frac{160}{56��2}$��583.2����1-5%��kg=0.791t��
�ʴ�Ϊ��0.791��
��7�����ݷ�Ӧ ��i��TiO2��g��+2C12��g���TTiC14��1��+O2��g����H=+141kJ•mol-1����ii��TiO2��g��+C��s��+2C12��g���TTiC14��1��+CO2��g����H=-218kJ•mol-1��֪����i����Ӧ�����ȡ��ؼ���Ӧ����ii���Ƿ��ȡ�������Ӧ�����Բ��ã�ii���Ʊ�TiC14�����ܲ��ã�i����ԭ���Ƿ�Ӧ��i�������������ؼ��ķ�Ӧ����״̬���κ��¶ȶ������Է���Ӧ��Mg�ڸ����»�ԭTiC14�������Ȼ�þ���ѣ���Ӧ�Ļ�ѧ����ʽΪTiCl4+2Mg$\frac{\underline{\;����\;}}{\;}$Ti+2MgCl2��
�ʴ�Ϊ����Ӧ�����������ؼ��ķ�Ӧ����״̬���κ��¶ȶ������Է���Ӧ��TiCl4+2Mg$\frac{\underline{\;����\;}}{\;}$Ti+2MgCl2��
���� ���⿼�����ʵ��Ʊ�ʵ�鷽������ƣ�������ѧ���ķ���������ʵ�������Ŀ��飬Ϊ�߿��������ͣ��Ѷ��еȣ�ע�����ʵ��Ļ���ԭ�������ʵ����ʣ�


 �п�������㾫��ϵ�д�
�п�������㾫��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ԭ������Ϊ15��Ԫ�ص�����ϼ�Ϊ+3 | |
| B�� | ��A��Ԫ����ͬ�����зǽ�������ǿ��Ԫ�� | |
| C�� | ԭ������Ϊ12��Ԫ��λ��Ԫ�����ڱ��ĵ������ڢ�A�� | |
| D�� | �ڶ����ڢ�A��Ԫ�ص�ԭ�Ӻ˵������������һ��Ϊ6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ͭ˿ȼ�շ� | B�� | �������� | ||
| C�� | ���ú������ | D�� | ���ú˴Ź������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CaCO3 | B�� | SiO2 | C�� | Na2SiO3 | D�� | Si |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com