


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:高中化学 来源:不详 题型:单选题
 HCOONa+H2O,下列有关说法不正确的是( )
HCOONa+H2O,下列有关说法不正确的是( ) | A.储氢、释氢过程均有能量变化 |
| B.NaHCO3、HCOONa均含有离子键和共价键 |
| C.储氢过程中,NaHCO3被还原 |
| D.释氢过程中,每消耗0.1mol H2O放出2.24L的H2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O |
| B.Zn+2HCl=ZnCl2+H2↑ |
| C.NaOH+HCl=NaCl+H2O |
| D.CuO+2HCl=CuCl2+H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.对硝基甲苯的结构简式: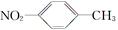 |
B.CH2F2的电子式: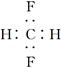 |
| C.16O2与18O2互为同素异形体 |
| D.乙炔的最简式:CH |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.50 mL 1 mol·L-1NaCl溶液 |
| B.20 mL 2 mol·L-1AlCl3溶液 |
| C.30 mL 1 mol·L-1MgCl2溶液 |
| D.100 mL 3 mol·L-1NaClO3溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
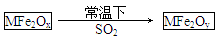
| A.MFe2Ox是还原剂 |
| B.SO2是该反应的催化剂 |
| C.x>y |
| D.SO2发生了置换反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
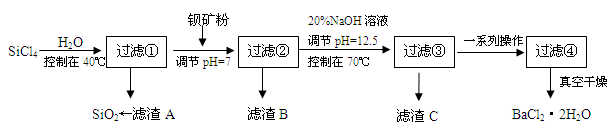
 溶液和
溶液和 溶液(中性)。请结合平衡原理和必要的文字解释滤渣C能溶于3mol/L的
溶液(中性)。请结合平衡原理和必要的文字解释滤渣C能溶于3mol/L的 溶液的原因______。
溶液的原因______。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.含有金属元素的离子一定是阳离子,金属阳离子被还原一定得到金属单质 |
| B.pH相等的NaOH、NaHCO3和Na2CO3三种溶液: c(NaOH)<c(NaHCO3)<c(Na2CO3) |
| C.常温下,c(NH4+)相等的4种溶液:①(NH4)2SO4②(NH4)2Fe(SO4)2③NH4Cl ④(NH4)2CO3,溶质物质的量浓度大小关系是:②<①<④<③ |
| D.某温度时水的离子积常数KW=10-13若将此温度下pH=11的NaOH溶液aL与pH=1的稀硫酸bL混合,若所得混合液pH=2,则a:b=2:9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com