
| A、SO32-→SO2 |
| B、HCl→Cl2 |
| C、Al→AlO2- |
| D、SO2→S |
科目:高中化学 来源: 题型:
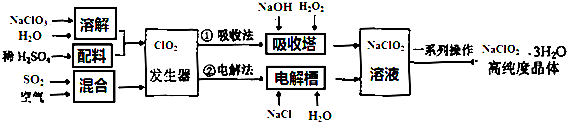
| A、发生器中鼓入空气的作用是将SO2氧化成SO3 |
| B、吸收塔中加入的H2O2可以用Na2O2代替 |
| C、电解槽中阴极的反应为ClO2+e-=ClO2- |
| D、一系列操作中必不可少的步骤是重结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Q2=2 Q1 |
| B、Q2<Q1<197 kJ |
| C、Q2=Q1<197 kJ |
| D、以上均不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaAlO2溶液中滴加过量盐酸:AlO2-+H2O+H+=Al(OH)3 | ||||
B、NH4HSO3溶液与足量浓NaOH溶液共热:NH4++HSO3-+2OH-
| ||||
| C、明矾溶于水产生Al(OH)3 胶体:Al3++3H2O=Al(OH)3↓+3H+ | ||||
| D、FeCl3溶液与Cu反应:Fe3++Cu=Fe2++Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D |
 | 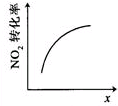 |  | 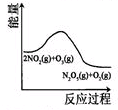 |
| t1时仅加入催化剂,平 衡向正方向移动 | 达平衡时,仅改变x, 则x为c(O2) | 从反应开始达平衡气体浓度变化 | 升高温度,平衡常数 减小 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com