
���� ��1����Ԫ���ڻ�������ֻ���γ�+1�ۣ��ݴ˽���������������ʵ����ж��仯ѧʽ���ɣ�
��2��NaAlH4��ˮ��Ӧ����������Ӧ��ˮ�е�HԪ����NaH�е�HԪ��֮���ʧ���ӣ��ݴ���д���ɣ�
��3���������֪NaH������ԭ����ô����Ϊ����������Ӧ���������ʣ��ݴ���д��
��4���Ʊ�������δָ��������������HCl���ݴ˽������������Ʒ�Ӧδָ���Ƶ��������ƿ��ܹ�������������Ҳ������ˮ��Ӧ����������
��� �⣺��1��Na�ڻ��ϼ��г���+1�ۣ��ʸ����ʵĻ�ѧʽ����ΪNaH���ּ���AlCl3��Ӧ�ɵõ�NaAlH4��Al�Ļ��ϼ�Ϊ+3����HԪ�صĻ��ϼ�Ϊ-1��4.80g��������ȫ�ֽ⣬�õ������ƺ�2.24L����0.1mol������
��ѧ��Ӧ����ʽΪ��2NaH$\frac{\underline{\;\;��\;\;}}{\;}$2Na+H2��
48g 22.4L
4.8g 2.24L
�ʴ˻�����ΪNaH���ʴ�Ϊ��NaH��
��2��NaAlH4��ˮ��Ӧ������������NaH��H���ϼ����ߣ�ˮ��HԪ�ػ��ϼ۽��ͣ���ѧ��Ӧ����ʽΪ��NaAlH4+2H2O=NaAlO2+4H2�����ʴ�Ϊ��NaAlH4+2H2O=NaAlO2+4H2����
��3��NaH������ԭ����H���ϼ�����Ϊ+1�ۣ��������ڴ�Ϊ��������Fe���ϼ۽���Ϊ0�ۣ�����Ӧ���������ʣ���ѧ��Ӧ����ʽΪ��3NaH+Fe2O3=2Fe+3NaOH��
�ʴ�Ϊ��3NaH+Fe2O3=2Fe+3NaOH��
��4��ϡ������лӷ��ԣ��ҿ�������Ũ����������ȡ�������п��ܻ�����������HCl����ô��ȡ�ļ��оͻ���NaCl����֤������δ�ų������Ƶĸ��ţ������Ľ�����Ҳ������ˮ��Ӧ����������
�ʴ�Ϊ���Ʊ����̲���������Ϊ�����ӷ��������л���HCl�����²�������NaCl���鴿�����������������Na������Na��ˮ��ӦҲ������������û�п��ǻ����NaCl��
���� ������Ҫ������dz���Ԫ���Լ��仯�����֪ʶ���ۺ��Խ�ǿ���漰���ʵ��жϡ���ѧ��Ӧ����ʽ��д��ʵ�鷽�������۵ȣ��ѶȽϴ�


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2��3��6 | B�� | 6��3��2 | C�� | 1��2��3 | D�� | 3��2��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
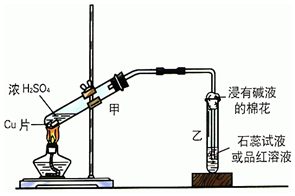 ʵ���ҳ�����ͼװ��������ͭ��Ũ���ᷴӦ��һϵ��ʵ�飮
ʵ���ҳ�����ͼװ��������ͭ��Ũ���ᷴӦ��һϵ��ʵ�飮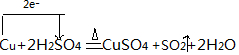
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
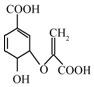
| A�� | ����ʽΪC9H10O6 | |
| B�� | �����Ҵ������ᷴӦ���ҷ�Ӧ������ͬ | |
| C�� | ��ʹ���������̼��Һ�����Ը��������Һ��ɫ����ԭ����ͬ | |
| D�� | �����к������ֹ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ֹ��Ʊ������費�漰������ԭ��Ӧ | |
| B�� | �轺������ʵ��ʱ�ʹ�װʳƷ��ƿװҩƷ�ĸ���� | |
| C�� | �����Ĺ�������ά��ԭ�� | |
| D�� | ˮ�������Ͳ����ϵĴ��̶��ǹ�������Ʒ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 3Fe+4H2O��g�� $\frac{\underline{\;\;��\;\;}}{\;}$Fe3O4+4H2 | |
| B�� | 3NO2+H2O�T2HNO3+NO | |
| C�� | Ca��OH��2+SO2�TCaSO3+H2O | |
| D�� | Cu+2H2SO4 ��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$CuSO4+SO2��+2H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��H+����Һ | |
| B�� | pH��7����Һ | |
| C�� | c��OH-����c��H+������Һ | |
| D�� | 25��ʱ����ˮ���������c��H+��=1��10-9mol/L����Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �Ȼ�����Һ�������ˮ�ķ�Ӧ��Al3++3OH-�TAl��OH��3�� | |
| B�� | ��ˮ��⻯����Һ�ķ�Ӧ��Cl2+2I-�T2Cl-+I2 | |
| C�� | ����������ϡ����ķ�Ӧ��2Fe+3H+�T2Fe3++3H2�� | |
| D�� | ������ˮ��Ӧ��Cl2+H2O�T2H++Cl-+ClO- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ��ѧ�� | ���� | ��ѧ�� | ���� | ��ѧ�� | ���� | ��ѧ�� | ���� |
| C-H | 414 | C-F | 489 | H-F | 565 | F-F | 158 |
| H-H | 436 | H-N | 391 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com