
【题目】下列说法正确的是( )
A.某试样焰色反应呈黄色,则试样中可能含有K+
B.广泛pH试纸测得某新制氯水的pH为4
C.配制240mL某溶液,应选240mL容量瓶
D.可用排饱和食盐水来收集纯净的氯气
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
【题目】下列图像中的曲线(纵坐标为沉淀或气体的量,横坐标为加入物质的量),其中错误的是

A.图A表示向含H+、Mg2+、Al3+、NH4+的溶液中滴加NaOH溶液产生沉淀量的关系曲线
B.图B表示向澄清石灰水中通入二氧化碳直至过量产生沉淀量的关系曲线
C.图C表示向NaOH和Na2CO3的混合液中滴加盐酸产生CO2气体的关系曲线
D.图D表示向明矾溶液中滴加Ba(OH)2溶液产生沉淀量的关系曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t ℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g)![]() 2Z(g),各组分在不同时刻的浓度如下表:
2Z(g),各组分在不同时刻的浓度如下表:
物质 | X | Y | Z |
初始浓度/(mol·L-1) | 0.1 | 0.2 | 0 |
2 min末浓度/(mol·L-1) | 0.08 | a | b |
平衡浓度/(mol·L-1) | 0.05 | 0.05 | 0.1 |
下列说法正确的是( )
A.平衡时,X的转化率为20%
B.t ℃时,该反应的平衡常数为40
C.增大平衡后的体系压强,v(正)增大,v(逆)减小,平衡向正反应方向移动
D.前2 min内,用Y的变化量表示的平均反应速率v(Y)=0.03 mol·(L·min)-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是 ( )
A. 磁性氧化铁溶于稀硝酸:Fe3O4+8H+=Fe2++2Fe3++4H2O
B. 往NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH- ![]() NH3↑+H2O
NH3↑+H2O
C. 往酸性碘化钾溶液中滴加适量的双氧水:2H++2I-+H2O2=I2 + 2H2O
D. 向NaHSO4溶液中滴加Ba(OH)2溶液反应至中性:H++SO42+ Ba2++OH-=BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数约为6.02×1023mol-1,下列叙述中正确的是( )
A. 7.8 g Na2S和Na2O2的混合物中含有阴离子数大于0.1×6.02×1023
B. 2 mol NO和1 mol O2混合在密闭容器中,容器内物质分子数小于2×6.02×1023
C. 6.8 g熔融的KHSO4中含有0.1NA个阳离子
D. 1.00 mol NaCl中,所有Na+的最外层电子总数为10×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeBr2是一种黄绿色固体,某学习小组制备并探究它的还原性。
I.实验室制备FeBr2
实验室用下图所示装置制取溴化亚铁。其中A为CO2发生装置,D和d中均盛有液溴,E为外套电炉丝的不锈钢管。e是两只耐高温的瓷皿,其中盛有细铁粉。
实验开始时先将铁粉加热至600℃~700℃,然后将干燥、纯净的CO2气流通入D中,E管中反应开始,不断将d中液溴滴入约120℃的D中,经过几小时的连续反应,在E管的一端沉积有黄绿色鳞片状溴化亚铁。
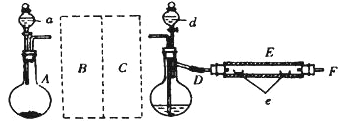
请回答:
(1)仪器D的名称是__。给D加热最好选择下列加热器中的__。

(2)若在A中烧瓶中盛固体CaCO3,a中盛6mol·L-1盐酸,为使导入D中的CO2为干燥纯净的气体,则图中B、C处的装置所装的试剂是:B为_______,C为_______。为防止污染空气,实验时应在F处连接盛有__ 溶液的尾气吸收装置。
(3)实验时,装置D和E的橡胶管用铝箔包住,且连接D、E之间的橡胶管可能短的原因是______。
(4)①E管反应前先通入一段时间CO2,其主要作用是________;
②反应过程中要继续通入CO2,其主要作用是________。
II.探究FeBr2的还原性
某课外小组学生对Cl2与 FeBr2溶液反应进行实验探究。
操作 | 现象 |
取0.1mol/L的FeBr2溶液100mL,测溶液的pH | pH试纸变红(约为4) |
| i. 开始通入100mLCl2(折合标班状况),溶液由浅绿色逐渐变黄; ii.稍后,继续通入Cl2,溶液黄色加深,变为棕黄色; iii.稍后,溶液由棕黄色变浅,最终变为黄色 |
(5)现象i中溶液由浅绿色逐渐变黄。某学生猜测可能原因:①Cl2将Fe2+氧化为Fe3+、使溶液呈黄色;②Cl2将Br-氧化为Br2,使溶液呈黄色。
请设计实验证明现象i中溶液由浅绿色变黄色的原因是原因①还是原因②:___________。
(6)若向上述FeBr2溶液中通入168mLCl2(标准状况),则反应的离子方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前20号元素A、B、C、D,其中A元素所处的周期数、主族序数、原子序数均相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C。
(1)C在周期表中的位置_____________________________;
(2)B 元素的原子结构示意图______________________;
(3)化合物D2C的电子式_____________________________;
(4)B最简单气态氢化物与最简单的有机物的稳定性强弱关系(用相应的化学式表示):____ > ____;
(5)C、D离子的半径大小关系为C______D (填:>、=、<);
(6)B的氢化物与B的最高价氧化物对应水化物反应的生成物中含有的的化学键有__________填选项)。
A、只含离子键 B、既有离子键又有共价健
C、只含有共价键 D、既有极性共价键又有非极性共价键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com