
·ÖĪö Čō½«Na2CO3ČÜŅŗµĪČėŃĪĖįČÜŅŗ£¬ŌņŃĪĖįĻą¶Ō¹żĮ棬ĖłÓŠCO32-¶¼»į×Ŗ»ÆĪŖCO2£»·“Ö®£¬½«ŃĪĖįČÜŅŗµĪČėNa2CO3ČÜŅŗ£¬ŌņŃĪĖįĻą¶Ō²»×ć£¬Ē°Ņ»²æ·ÖŃĪĖį½«CO32-ĻČ×Ŗ»ÆĪŖHCO3-£¬ŗóŅ»²æ·ÖŃĪĖįŹ¹Ö®×Ŗ»ÆĪŖCO2£¬ŅņĪŖĮ½“ĪĖłµĆCO2 Ģå»ż²»Ķ¬£¬ĖµĆ÷15mLNa2CO3Ļą¶ŌÓŚ25mLŃĪĖįĄ“Ėµ¹żŹ££¬ĖłŅŌŅŅŹĒĢ¼ĖįÄĘ£¬¼×ŹĒŃĪĖį£¬½įŗĻ·“Ó¦µÄĄė×Ó·½³ĢŹ½¼ĘĖć£®
½ā“š ½ā£ŗ£Ø1£©µ±ĻņŃĪĖįÖŠ¼ÓČėNa2CO3ČÜŅŗŹ±£¬·¢Éś·“Ó¦2H++CO32-ØTCO2”ü+H2O£¬ŃĪĖįĶźČ«·“Ó¦ŗó£¬ŌŁ¼ÓČėµÄNa2CO3²»ŌŁ·Å³öCO2£»ĻņNa2CO3ČÜŅŗÖŠ¼ÓČėŃĪĖįŹ±£¬ĻČ·¢Éś·“Ó¦CO32-+H+ØTHCO3-£¬µ±ĖłÓŠCO32- ¾ł×Ŗ»ÆĪŖHCO3- Ź±£¬ŌŁ·¢Éś·“Ó¦HCO3-+H+ØTCO2”ü+H2O£®ÓÉŹµŃé¢Ł¢ŚÖŠŹż¾ŻæÉÖŖµČĮæµÄ¼×ÓėµČĮæµÄŅŅ·“Ó¦£¬ŹµŃé¢Ł²śÉśµÄCO2ĘųĢå¶ą£¬ĖµĆ÷¼×ĪŖHCl”¢ŅŅĪŖNa2CO3£¬¹Ź“š°øĪŖ£ŗHCl£»Na2CO3£»
£Ø2£©ĻņNa2CO3ČÜŅŗÖŠ¼ÓČėŃĪĖįŹ±£¬ĻČ·¢Éś·“Ó¦CO32-+H+ØTHCO3-£¬µ±ĖłÓŠCO32- ¾ł×Ŗ»ÆĪŖHCO3- Ź±£¬ŌŁ·¢Éś·“Ó¦HCO3-+H+ØTCO2”ü+H2O£¬
¹Ź“š°øĪŖ£ŗCO32-+H+ØTHCO3-”¢HCO3-+H+ØTCO2”ü+H2O£»
£Ø3£©ÉčŃĪĖįµÄĪļÖŹµÄĮæÅضČĪŖc£ØHCl£©£¬Na2CO3ČÜŅŗµÄĪļÖŹµÄĮæÅضČĪŖc£ØNa2CO3£©£¬
ĮæČ”25.00mL¼×ČÜŅŗ£¬ĻņĘäÖŠ»ŗĀżµĪ¼ÓŅŅČÜŅŗ15.00mL£¬¹²ŹÕ¼Æµ½¶žŃõ»ÆĢ¼224mL£¬n£ØCO2£©=0.01mol£¬
2HCl+Na2CO3=2NaCl+H2O+CO2”ü£¬HClĶźČ«·“Ó¦£¬Na2CO3Ź£Óą£¬n£ØHCl£©=2n£ØCO2£©=2”Į0.01mol=0.02 mol£¬
c£ØHCl£©=$\frac{0.02mol}{0.025L}$=0.8 mol•L-1£»
ĮķČ”15.00mLŅŅČÜŅŗ£¬ĻņĘäÖŠ»ŗĀżµĪ¼Ó¼×ČÜŅŗ25.00mL£¬n£ØHCl£©=0.8mol/L”Į0.025/L=0.02mol£¬¹²ŹÕ¼Æµ½¶žŃõ»ÆĢ¼112mL£¬HClÓėNa2CO3¾łĶźČ«·“Ó¦£¬Na2CO3ĻČÉś³ÉNaHCO3£¬²æ·ÖNaHCO3 ×Ŗ»ÆĪŖCO2£ŗn£ØCO2£©=0.005mol£»HCl+Na2CO3=NaHCO3+NaCl£¬HCl+NaHCO3=NaCl+H2O+CO2”ü£¬ŌŚ¢ŚÖŠ£¬²śĘų0.005mol£¬ĖµĆ÷µŚ¶ž·“Ó¦ŃĪĖįÓĆČ„0.005mol£¬²ĪÓėµŚŅ»·“Ó¦µÄ¾ĶŹĒ0.015mol£¬ÄĒĆ“Ģ¼ĖįÄʵÄĮæ¾ĶŹĒ0.015mol£¬c£ØNa2CO3£©=$\frac{0.015mol}{0.015L}$=1mol/L£¬
¹Ź“š°øĪŖ£ŗ0.8 mol•L-1£»1 mol•L-1£»
£Ø4£©µČĢå»żµÄ¼×”¢ŅŅ°“ŹµŃé¢ŁµÄ·½Ź½½ųŠŠŹ±²śÉśĘųĢåµÄĢå»żĪŖ£ŗ$\frac{1}{2}$”Įn”Į10-3 L”Į0.8 mol•L-1”Į22.4 l•mol-1=8.96”Į10-3 nL£¬
Čō°“ŹµŃé¢ŚµÄ·½Ź½½ųŠŠ£¬ÓÉ·“Ó¦CO32-+H+ØTHCO3- æÉÖŖŃĪĖį²»×ć£¬²»²śÉśĘųĢ壬¹Ź0”ÜV”Ü8.96 n£¬
¹Ź“š°øĪŖ£ŗ0”ÜV”Ü8.96n£®
µćĘĄ ±¾Ģāæ¼²é»Æѧ·½³ĢŹ½µÄ¼ĘĖć£¬²ąÖŲӌѧɜµÄ·ÖĪöÄÜĮ¦ŗĶ¼ĘĖćÄÜĮ¦µÄ漲飬עŅā°ŃĪÕ·“Ó¦µÄĄė×Ó·½³ĢŹ½»ņ»Æѧ·½³ĢŹ½£¬øł¾Ż·½³ĢŹ½½įŗĻÖŹĮæŹŲŗć¼ĘĖćøĆĢā£¬ÄѶČÖŠµČ£®


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĢśÖĘ¹ÜµĄĶæĀĮ·ŪæÉ·ĄŠāŹ“ | |
| B£® | Ģ¼Ėį±µ”¢Ģ¼ĖįĒāÄĘ”¢ĒāŃõ»ÆĆ¾µČ¾łæÉ×÷ĪŖæ¹ĖįŅ©ĪļŹ¹ÓĆ | |
| C£® | ŗøĪżÖŠ¼ÓĒ¦µÄÄæµÄŹĒĢįøßČŪµć | |
| D£® | ÓĆ·Ļ¾ÉʤøļÉś²śŅ©ÓĆ½ŗÄŅæÉŅŌĢįøßŌĮĻĄūÓĆĀŹ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | X µÄÄÜĮæŅ»¶ØøßÓŚM | |
| B£® | Y µÄÄÜĮæŅ»¶ØøßÓŚN | |
| C£® | X ŗĶY µÄ×ÜÄÜĮæŅ»¶ØøßÓŚM ŗĶN µÄ×ÜÄÜĮæ | |
| D£® | ŅņøĆ·“Ó¦ĪŖ·ÅČČ·“Ó¦£¬¹Ź²»±Ų¼ÓČČ¾ĶæÉ·¢Éś |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ±ź×¼×“æöĻĀ£¬22.4LH2Oŗ¬ÓŠµÄ·Ö×ÓŹżĪŖ1 NA | |
| B£® | ³£ĪĀ³£Ń¹ĻĀ£¬16g O2ŗ¬ÓŠµÄŌ×ÓŹżĪŖ1 NA | |
| C£® | Ķس£×“æöĻĀ£¬1 NA øöSO2·Ö×ÓÕ¼ÓŠµÄĢå»żĪŖ22.4L | |
| D£® | ĪļÖŹµÄĮæÅضČĪŖ0.5mol/LµÄK2CO3ČÜŅŗÖŠ£¬ŗ¬ÓŠCO32-øöŹżĪŖ0.5 NA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ±ź×¼×“æöĻĀ£¬22.4L H2Oŗ¬ÓŠµÄ·Ö×ÓŹżĪŖ1NA | |
| B£® | ³£ĪĀ³£Ń¹ĻĀ£¬1.06g Na2CO3ŗ¬ÓŠµÄNa+Ąė×ÓŹżĪŖ0.02NA | |
| C£® | ³£ĪĀ³£Ń¹ĻĀ£¬22.4L CO2ĘųĢåŗ¬ÓŠŌ×ÓŹżĪŖ3NA | |
| D£® | ĪļÖŹµÄĮæÅضČĪŖ0.5mol/LµÄMgCl2ČÜŅŗÖŠ£¬ŗ¬ÓŠCl-øöŹżĪŖ1NA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ÄĘÓėæÕĘų | B£® | ĀĮŃĪÓėĒāŃõ»ÆÄĘČÜŅŗ | ||
| C£® | CO2ĶØČėŹÆ»ŅĖ® | D£® | ¹żŃõ»ÆÄĘÓėĖ® |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
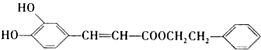 ŹĒŅ»ÖÖĢģČ»æ¹°©Ņ©Īļ£¬ŌŚŅ»¶ØĢõ¼žĻĀÄÜ·¢ÉśČēĻĀ×Ŗ»Æ£ŗ
ŹĒŅ»ÖÖĢģČ»æ¹°©Ņ©Īļ£¬ŌŚŅ»¶ØĢõ¼žĻĀÄÜ·¢ÉśČēĻĀ×Ŗ»Æ£ŗ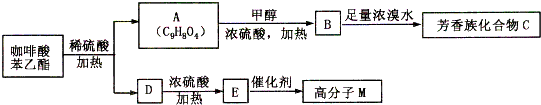
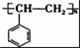 £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ±ź×¼×“æöĻĀ£¬22.4LŅŅ“¼ÖŠŗ¬ÓŠµÄŃõŌ×ÓŹżÄæĪŖNA | |
| B£® | 6.4gµÄS2ŗĶS8»ģŗĻĪļÖŠ£¬ŗ¬ĮņŌ×Ó×ÜŹżĪŖ0.2NA | |
| C£® | 0.1 mol•L-1µÄNaHSO4ČÜŅŗÖŠŗ¬ÓŠŃōĄė×ÓµÄ×ÜŹżĪŖ0.2NA | |
| D£® | 7.8 g Na2O2ÓėĖ®·“Ó¦£¬×ŖŅʵĵē×Ó×ÜŹżĪŖ0.2NA |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com