
| A、该溶液的pH值一定等于1 |
| B、阴离子肯定有I-,不能确定有无HCO3- |
| C、阳离子肯定没有Fe3+,一定有Na+ |
| D、该溶液含有的溶质成分可能为HI或HI和NaI或NaI和NaOH |


科目:高中化学 来源: 题型:
| 1 |
| 10 |
| A、①④ | B、①② | C、②④ | D、③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 物质 | 甲苯 | 1-丙醇 | 1-溴丙烷 |
| 沸点℃ | 110.8 | 97.2 | 71 |
| 物质 | 对溴甲苯 | 邻溴甲苯 | |
| 沸点℃ | 184.3 | 181.7 | |

查看答案和解析>>
科目:高中化学 来源: 题型:
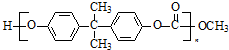


查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、③④⑤⑥ | B、②③④⑥ |
| C、①③④⑤ | D、①③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓硫酸可刻蚀石英制艺术品 |
| B、镧镍合金能大量吸收H2形成金属氢化物,可作储氢材料 |
| C、在食盐中添加适量的碘酸钾 |
| D、用浸泡过高锰酸钾溶液的硅藻土保鲜水果 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3 mol/L |
| B、4 mol/L |
| C、5 mol/L |
| D、6 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com