
| A. | 同温下,0.1 mol•L-1NH4Cl溶液中NH4+的浓度比0.1 mol•L-1氨水中NH4+的浓度大 | |
| B. | 用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl多 | |
| C. | 电解饱和食盐水时,阴极得到氢氧化钠溶液和氢气 | |
| D. | 除去溶液中的Mg2+,用OH-比CO32-效果好,说明Mg(OH)2的溶解度比MgCO3的小 |
分析 A、一水合氨是弱电解质存在电离平衡;
B、依据氯化银存在的沉淀溶解平衡分析判断;
C、电解饱和食盐水阳极上氯离子失电子生成氯气,阴极上是氢离子得到电子生成氢气,破坏水的电离平衡,氢氧根离子浓度增大;
D、氢氧化镁溶解度小于碳酸镁.
解答 解:A.相同温度下,一水合氨是弱电解质存在电离平衡,电离程度微弱,所以0.1mol•L-1NH4Cl溶液中NH4+的浓度比0.1mol•L-1氨水中NH4+的浓度大,故A正确;
B.氯化银沉淀存在沉淀溶解平衡,AgCl(s)?Ag+(aq)+Cl-(aq),用稀盐酸洗涤AgCl沉淀,氯离子浓度增大,平衡逆向进行,所以比用水洗涤损耗AgCl小,故B错误;
C.电解饱和食盐水时,阳极上氯离子失电子生成氯气,阴极上是氢离子得到电子生成氢气,阴极得到氢氧化钠溶液和氢气,故C正确;
D.除去溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3的小,故D正确.
故选B.
点评 本题考查了弱电解质电离分析,盐类水解的分析应用,电解原理和产物的判断,沉淀溶解平衡的分析判断是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | CO2的电子式: | B. | Cl-的结构示意图: | ||
| C. | 乙醇的结构式:CH3CH2OH | D. | 乙烯的结构简式:CH2CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
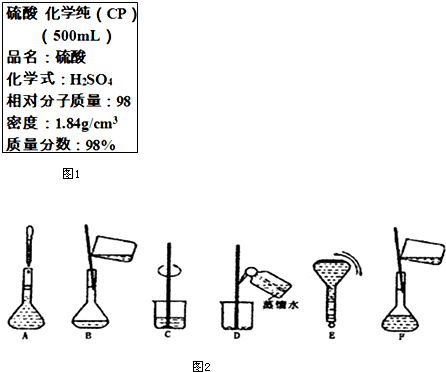 如图1是硫酸试剂瓶标签上的部分内容.现实验室需要240ml 4.6mol/L的稀硫酸用该硫酸配置,
如图1是硫酸试剂瓶标签上的部分内容.现实验室需要240ml 4.6mol/L的稀硫酸用该硫酸配置,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COONa | B. | NH3•H2O | C. | HCl | D. | H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤③ | B. | ②③④③ | C. | ②③⑤③ | D. | ①③⑤③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
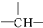 ,n个-C2H5,a个
,n个-C2H5,a个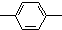 ,其余为氯原子,则氯原子的数目可能是( )
,其余为氯原子,则氯原子的数目可能是( )| A. | m+2-n | B. | n+2a-3m | C. | n+m+a | D. | a+n+2-2m |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在炭粉中加入KClO3,点燃时燃烧更为剧烈 | |
| B. | 锌与稀硫酸反应中加入少量CuSO4溶液而使反应放出H2的速率加快 | |
| C. | 双氧水中加入少量FeCl3,可加快放出气体的速率 | |
| D. | 固态FeCl3和固体NaOH混合后,加入水能迅速产生沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com