


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、K+、Cu2+、Cl-、SO42- |
| B、HCO3-、NO3-、SO42-、Na+ |
| C、Cl-、SO42-、K+、Na+ |
| D、Na+、SO42-、Cl-、AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃时,0.1mol?L-1HF 溶液中pH=2 |
| B、Ksp(CaF2)随温度和浓度的变化而变化 |
| C、该体系中没有沉淀产生 |
| D、该体系中HF与CaCl2反应产生沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③ | B、①②③ |
| C、①④ | D、①②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、制取氢氧化铁胶体,可向沸水中加入FeCl3溶液 |
| B、加热蒸发NaHCO3溶液,最终可获得NaOH固体 |
| C、向醋酸溶液中加入固体的醋酸钠,可增大醋酸的电离度 |
| D、配制SnCl2溶液时,可加入过量的硫酸,抑制水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃时、用醋酸溶液滴定等浓度NaOH溶液至pH=7,V醋酸<VNaOH |
| B、饱和小苏打溶液中:c(Na+)=c(HCO3-) |
| C、Na2CO3溶液中加入少量Ca(OH)2 固体,CO32-水解程度减小,溶液的pH 减小 |
| D、室温下,对于0.10 mol?L-1的氨水,用HNO3溶液完全中和后,溶液不显中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
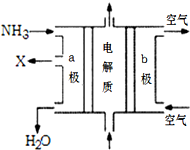 以下是对化学反应变化过程及结果的研究.按要求回答问题:
以下是对化学反应变化过程及结果的研究.按要求回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com