
| A. | 为了加快过滤速度,可用玻璃棒搅拌过滤器中的液体 | |
| B. | 为了防止容量瓶漏液,可在玻璃塞上涂上凡士林 | |
| C. | 为了使制取氢气的速率加快,可向稀硫酸中加入少量硫酸铜溶液 | |
| D. | 为了使配制的FeCl3溶液不产生混浊,可加入盐酸和铁片 |
分析 A.过滤器中的液体不能用玻璃棒搅拌;
B.在玻璃塞上涂凡士林会使溶液受到污染;
C.Zn和硫酸的反应中加入少量的CuSO4溶液,能置换出一定量Cu,在溶液中形成Cu/Zn原电池,原电池反应比化学反应速率快;
D.Fe3+易水解,水解生成H+,配制溶液时,可加入盐酸抑制FeCl3水解,防止生成沉淀而导致溶液变浑浊.
解答 解:A.用玻璃棒搅拌过滤器中的液体可能将滤纸弄破,使实验失败,故A错误;
B.容量瓶是用来配制标准溶液的,在玻璃塞上涂凡士林会使溶液受到污染,故B错误;
C.Zn比Cu活泼,可置换出Cu,反应的方程式为CuSO4+Zn=ZnSO4+Cu,在溶液中形成Cu/Zn原电池,而加快化学反应速率,故C正确;
D.Fe3+易水解,水解生成H+,水解的离子方程式为Fe3++3H2O?Fe(OH)3+3H+,配制溶液时,可加入酸抑制FeCl3水解,防止生成沉淀而导致溶液变浑浊,由于溶液是FeCl3溶液,加铁片,Fe+2FeCl3=3FeCl2,反而加剧变质,故D错误;
故选C.
点评 本题主要考查基本实验操作等相关内容,在化学实验操作时,注意常见化学实验操作的注意事项,题目难度不大,注意D选项把握水解原理的应用.


科目:高中化学 来源: 题型:选择题
| A. | 1803 年道尔顿提出的“元素的原子以其原子质量为特征” | |
| B. | 1808 年盖•吕萨克提出的“同温同压下,相同体积的不同气体含有相同数目的原子” | |
| C. | 1811 年贝来里乌斯提出的“不同原子显不同电性,因而产生吸引力形成化合物“ | |
| D. | 1887 年阿伦尼乌斯提出的“电解质在溶液中会自发离解成带电的粒子” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、OH-、Ba2+、NO3- | B. | Al3+、AlO2-、HCO3-、Na+ | ||
| C. | Na+、Fe3+、SO42-、I- | D. | Fe3+、SCN-、Na+、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,pH=1的醋酸溶液中含有H+的数目为0.1NA | |
| B. | 100mL 18.4mol•L-1 的浓硫酸与足量的铜加热反应后,生成SO2 分子数为0.92NA | |
| C. | 将CO2 通过Na2O2 ,当固体质量增加a g时,反应中转移的电子数为a$\frac{{N}_{A}}{28}$ | |
| D. | 标准状况下,11.2L正丁烷所含公用电子对数为7NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 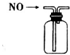 装置可收集NO气体 | |
| B. |  装置可吸收多余氨气且能防止倒吸 | |
| C. |  装置可实现反应:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑ | |
| D. | 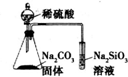 装置可证明非金属性:S>C>Si |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1molNa2O2所含的阴离子 | |
| B. | 1L0.1mol•L-1氨水中的NH4+ | |
| C. | 12.5mL16mol•L-1的浓硫酸能溶解的Cu | |
| D. | 4.6gNO2气体所含的分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com