
| A. | $\frac{KW}{c(H+)}$=1×10-13 mol•L-1的溶液中:Fe2+、K+、NO3-、SO42- | |
| B. | 使酚酞试液变红色的溶液中:Na+、Ba2+、NO3-、Cl- | |
| C. | c(Fe3+)=0.1 mol•L-1的溶液中:Na+、Cl-、SCN-、SO42- | |
| D. | 水电离的c(H+)=1×10-13 mol•L-1的溶液中:K+、Na+、Br-、HCO3- |
分析 A.$\frac{KW}{c(H+)}$=1×10-13 mol•L-1的溶液,显酸性;
B.使酚酞试液变红色的溶液,显碱性;
C.离子之间结合生成络离子;
D.水电离的c(H+)=1×10-13 mol•L-1的溶液,为酸或碱溶液.
解答 解:A.$\frac{KW}{c(H+)}$=1×10-13 mol•L-1的溶液,显酸性,Fe2+、H+、NO3-发生氧化还原反应,不能共存,故A错误;
B.使酚酞试液变红色的溶液,显碱性,该组离子之间不反应,可大量共存,故B正确;
C.Fe3+、SCN-结合生成络离子,不能共存,故C错误;
D.水电离的c(H+)=1×10-13 mol•L-1的溶液,为酸或碱溶液,酸、碱溶液中均不能大量存在HCO3-,故D错误;
故选B.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应、络合反应分析,题目难度不大.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:选择题
| A. | 只有第2列元素的原子最外层有2个电子 | |
| B. | 第14列元素形成化合物种类最多 | |
| C. | 第3列元素种类最多 | |
| D. | 第17、18列元素都是非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X与Y只能形成一种化合物 | |
| B. | 原子半径:r(Z)<r(Y)<r(W) | |
| C. | W的简单氢化物的热稳定性比Z的强 | |
| D. | Y的最高价氧化物对应的水化物是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

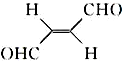 ,下列叙述正确的有AD.
,下列叙述正确的有AD.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化石燃料脱硫、脱硝处理 | B. | 工业废水经处理达标排放 | ||
| C. | 废电子产品统一回收处理 | D. | 农作物秸秆就地露天焚烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室用Zn和稀硫酸制H2,为加快反应速率,可向稀硫酸中加入少量Cu粉 | |
| B. | CH3Cl(g)+Cl2(g)$\stackrel{光照}{→}$CH2Cl2(l)+HCl(g)常温下能自发进行,则该反应的△H>0 | |
| C. | 在一体积可变的恒温密闭容器中发生反应PCl3(g)+Cl2(g)?PCl5(g),压缩体积,平衡正向移动,K值增大 | |
| D. | 25℃时Ka(HClO)=3.0×10-8,Ka(HCN)=4.9×10-10,若该温度下NaClO溶液与NaCN溶液pH相同,则c(NaClO)<c(NaCN) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷,丙烯 | B. | 乙烷,乙烯 | C. | 甲烷,乙烯 | D. | 乙烷,丙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
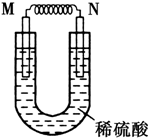 由铜片、铁片和200mL稀H2SO4组成的原电池中,若铁片只发生电化学反应,则当N极上共放出5.6L (标准状况)气体时,H2SO4恰好完全消耗.
由铜片、铁片和200mL稀H2SO4组成的原电池中,若铁片只发生电化学反应,则当N极上共放出5.6L (标准状况)气体时,H2SO4恰好完全消耗.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com