
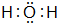 .
.分析 W、X、Y、Z为短周期内除稀有气体外的4种元素,它们的原子序数依次增大,其中只有Y为金属元素且其焰色反应为黄色,则Y为Na;Z的单质为淡黄色固体,则Z为S元素;Y、Z两元素原子的质子数之和为W、X两元素质子数之和的3倍,则W、X的质子数之和为$\frac{11+16}{3}$=9,Y和W的最外层电子数相等,则W为H元素、X为O元素,据此解答.
解答 解:W、X、Y、Z为短周期内除稀有气体外的4种元素,它们的原子序数依次增大,其中只有Y为金属元素且其焰色反应为黄色,则Y为Na;Z的单质为淡黄色固体,则Z为S元素;Y、Z两元素原子的质子数之和为W、X两元素质子数之和的3倍,则W、X的质子数之和为$\frac{11+16}{3}$=9,Y和W的最外层电子数相等,则W为H元素、X为O元素.
(1)W为H元素,Z为S元素,故答案为:H;S;
(2)H2O的电子式为: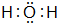 ,故答案为:
,故答案为: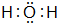 ;
;
(3)由Na、O、H组成的化合物为NaOH,含有离子键、共价键,故答案为:离子、共价;
(4)由H、O、Na、S四种元素组成的化合物为 NaHSO4、NaHSO3,这两种物质之间反应的离子方程式为:H++HSO3-=SO2↑+H2O,
故答案为:NaHSO4;NaHSO3;H++HSO3-=SO2↑+H2O.
点评 本题考查结构性质物质关系应用,元素单质的元素是推断突破口,熟练掌握元素化合物的组成与性质.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:选择题
| A. | NaOH、Na2O2、NH4Cl | B. | HCl、H2O、Cl2 | ||
| C. | MgCl2、NaF、KOH | D. | Xe、H2SO4、HF |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液呈紫色 | |
| B. | 溶液呈黄色 | |
| C. | 上层溶液接近无色,下层溶液呈紫红色 | |
| D. | 上层溶液呈紫红色,下层溶液呈无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
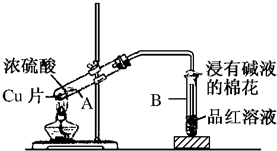
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | A | B | C |
| 结构信息 | 基态原子核外有两个电子层,最外层有3个未成对的电子 | 基态原子的M层有1对成对的p电子 | 基态原子核外M层全部充满,N层有一个未成对电子 |


查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3A+B=C | B. | 2A+2B=3C | C. | 4A+6B=9C | D. | 9A+6B=4C |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com