
 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源:不详 题型:单选题
| A.分子的稳定性:HF>H2O>NH3 | B.熔点:金刚石>汞>硫 |
| C.离子的半径:Cl->Al3+>Na+ | D.沸点:AsH3>PH3>NH3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子半径:Z>R>W | B.X2W6分子中各原子均满足8电子结构 |
| C.气态氢化物沸点:HmY>HnR | D.Y、Z、R三种元素组成的化合物水溶液一定显碱性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.氢 | B.碳 | C.氧 | D.硫 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.离子半径:Clˉ> F ˉ> Na+ > Al3+ |
| B.熔点:石英>食盐>冰>干冰 |
| C.结合氢离子的能力:SO42ˉ> SO32ˉ> CO32ˉ |
| D.热稳定性: HF > HCI > H2S > PH3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 元素代号 | X | Y | Z | W | V |
| 原子半径/nm | 0.090 | 0.118 | 0.075 | 0.073 | 0.102 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 | +6、-2 |
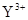 与
与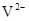 的核外电子数相等
的核外电子数相等查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
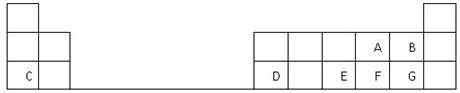
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
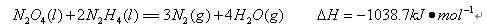
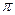 键有___________mol。[
键有___________mol。[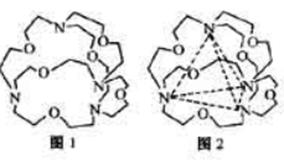
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com