
【题目】下列为元素周期表中的一部分:
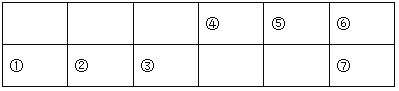
已知:⑤的氢化物常温下为气体,该气体可使湿润的红色石蕊试纸变蓝。
用化学式或元素符号回答下列问题:
(1) ④在周期表中的位置_______。
(2) ①②③中,最高价氧化物对应的水化物碱性最强的物质的电子式为_________。
(3) ①②⑥的简单离子半径由大到小的顺序是___________。(填离子符号)
(4) 用一个化学方程式证明Cl元素与⑦非金属性的强弱:____________。
(5) ①和⑥形成的一种化合物A中含有一种10电子微粒和一种18电子微粒,则A中含有的化学键类型为______。
(6) ⑥、⑦分别形成的氢化物沸点高的是_______(填化学式)。原因是_______。
(7) ①、③分别形成的最高价氧化物对应的水化物相互反应的离子方程式为_________。
【答案】 第二周期 第IVA族 ![]() O2->Na+> Mg2+ Cl2+H2S=S↓+2HCl(合理即可) 共价键和离子键 H2O H2O分子间存在氢键,氢键比分子间作用力强 OH-+Al(OH)3=AlO2-+2H2O
O2->Na+> Mg2+ Cl2+H2S=S↓+2HCl(合理即可) 共价键和离子键 H2O H2O分子间存在氢键,氢键比分子间作用力强 OH-+Al(OH)3=AlO2-+2H2O
【解析】本题分析:本题主要考查元素的性质。
⑤的氢化物常温下为气体,该气体可使湿润的红色石蕊试纸变蓝,该气体是氨,⑤是N。相应地①、②、③、④、⑥、⑦分别是Na、Mg、Al、C、O、S。
(1) ④在周期表中的位置:第二周期 、IVA。
(2) 金属性①>②>③中,最高价氧化物对应的水化物碱性最强的物质是氢氧化钠,其电子式为![]() 。
。
(3) ①②⑥的简单离子电子层结构与氖原子相同,离子半径随着核电荷数增大而减小,离子半径由大到小的顺序是O2->Na+> Mg2+。
(4) 用一个化学方程式证明Cl元素与⑦非金属性的强弱:Cl2+H2S=S↓+2HCl(合理即可)。
(5) A是过氧化钠,钠离子与过氧根之间存在离子键,过氧根内含有共价键,所以A中含有的化学键类型为共价键和离子键。
(6) ⑥、⑦分别形成的氢化物是水和硫化氢,沸点高的是H2O。原因是H2O分子间存在氢键,氢键比分子间作用力强。
(7) ①、③分别形成的最高价氧化物对应的水化物是氢氧化铝和氢氧化钠,相互反应的离子方程式为OH-+Al(OH)3=AlO2-+2H2O。


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 由H原子形成1 mol H—H键要吸收能量 B. 所有的燃烧反应都是放热反应
C. NaOH溶于水是放热反应 D. 凡经加热而发生的化学反应都是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:

步骤一:废铜屑制硝酸铜
如图,用胶头滴管吸取浓HNO3缓慢加到锥形瓶内的废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液。
步骤二:碱式碳酸铜的制备
向大试管中加入碳酸钠溶液和硝酸铜溶液,水浴加热至70℃左右,用0.400 mol·Lˉ1的NaOH溶液调节pH至8.5,振荡,静置,过滤,用热水洗涤,烘干,得到碱式碳酸铜产品。请回答:
(1)铜与浓硝酸反应的离子方程式 。
(2)上图装置中NaOH溶液的作用是 。
(3)步骤二中洗涤的目的是 。
(4)若实验得到2.42 g样品(只含CuO杂质),取此样品加热至分解完全后,得到1.80 g固体,此样品中碱式碳酸铜的质量分数是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各关于鉴别NaCl溶液和淀粉胶体的操作中,说法正确的是( )
A.只能丁达尔现象
B.只能用AgNO3溶液
C.只能用碘水
D.以上三种方法都可以
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列氯化物中,既能由金属和氯气直接反应制得,又能由金属和盐酸反应制得的是( )
A. CuCl2 B. FeCl2 C. FeCl3 D. AlCl3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com