
| A. | 向无色溶液中加入氯化钡溶液有白色沉淀生成,再加盐酸,沉淀不消失,则溶液中一定含有SO42- | |
| B. | 用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液 | |
| C. | 滴加硝酸化的AgNO3溶液后产生白色沉淀,说明该溶液一定含有Cl- | |
| D. | 向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含Fe2+ |
分析 A.白色沉淀为AgCl或硫酸钡;
B.焰色反应为元素的性质,火焰呈黄色,可知一定含Na元素;
C.白色沉淀为AgCl或硫酸银等;
D.滴加KSCN溶液,溶液不变色,可知不含铁离子,滴加氯水后溶液显红色,可知亚铁离子被氧化为铁离子.
解答 解:A.白色沉淀为AgCl或硫酸钡,则原溶液中可能含SO42-,故A不选;
B.焰色反应为元素的性质,火焰呈黄色,可知一定含Na元素,溶液可能为钠盐、NaOH等,故B不选;
C.白色沉淀为AgCl或硫酸银等,则该溶液中可能含有Cl-,故C不选;
D.滴加KSCN溶液,溶液不变色,可知不含铁离子,滴加氯水后溶液显红色,可知亚铁离子被氧化为铁离子,则该溶液中一定含Fe2+,故D选;
故选D.
点评 本题考查常见离子的检验,为高频考点,把握离子检验的试剂、现象、结论为解答的关键,侧重分析与实验能力的考查,注意排除干扰离子的影响,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
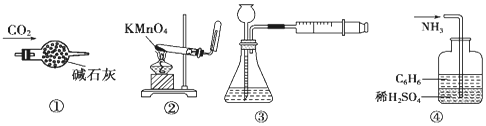
| A. | 装置①:干燥CO2 | B. | 装置②:实验室制取并收集O2 | ||
| C. | 装置③:装置气密性的检查 | D. | 装置④:吸收NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、NO3- | B. | S2-、AlO2- | C. | Al3+、Fe3+ | D. | MnO4-、NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,用秸秆可制得葡萄糖和酒精 | |
| B. | 铁制品表面涂“银粉”(铝粉)防生锈,是由于铝的化学性质比铁的稳定 | |
| C. | 氧气被用作火箭的燃料,利用了氧气的可燃性 | |
| D. | 稀有气体充入霓虹灯,利用了稀有气体通电时发出不同颜色的光的化学性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在熔融电解质中,O2-由负极移向正极 | |
| B. | 电池的正极通入丙烷 | |
| C. | 电路中每通过5 mol 电子,约有5.6 L标准状况下的丙烷被完全氧化 | |
| D. | 在电池正极的电极反应为O2-4e-═2O2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min | 0 | 30 | 70 | 80 | 100 |
| n(CO2)/mol | 0.10 | 0.060 | 0.040 | 0.040 | 0.040 |
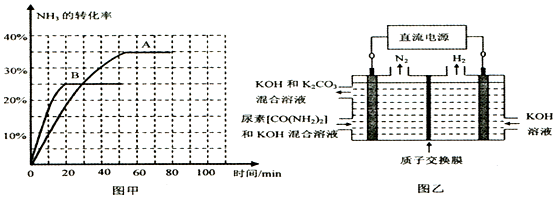
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | b中物质 | b中现象 | 结论或解释 | |
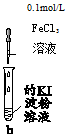 | A | Mg(OH)2悬浊液 | 有红棕色胶体产生 | 发生反应:Fe3++3OH-═Fe(OH)3(胶体) |
| B | Cu粉 | 溶液变蓝,试管底部有固体 | 溶液变蓝的原因是:3Cu+2Fe3+═2Fe+3Cu2+ | |
| C | 5%H2O2溶液 | 有气泡生成 | 该气体为氯气,双氧水强氧化性氧化Cl-产生 | |
| D | 饱和NaHCO3溶液 | 有气泡生成,且试管底部有固体 | 发生反应:Fe3++3HCO3-═Fe(OH)3+3CO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com