
【题目】五氯化磷(PCl5)是有机合成中重要的氯化剂,可以由三氯化磷(PCl3)氯化得到:
PCl3(g)+Cl2(g)![]() PCl5(g) ΔH=-93.0 kJ·mol-1。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol PCl3和1.0 mol Cl2,一段时间后反应达平衡状态,实验数据如下表所示:
PCl5(g) ΔH=-93.0 kJ·mol-1。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol PCl3和1.0 mol Cl2,一段时间后反应达平衡状态,实验数据如下表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl5)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
(1)0~150 s内的平均反应速率v(PCl3)=________mol·L-1·s-1。
(2)该温度下,此反应的化学平衡常数的数值为____(可用分数表示)。
(3)反应至250 s时,该反应放出的热量为________kJ。
(4)下列关于上述反应的说法中,正确的是______(填字母)。
a.无论是否达平衡状态,混合气体的密度始终不变
b.300 s时,升高温度,正、逆反应速率同时增大
c.350 s时,向该密闭容器中充入氮气,平衡向正反应方向移动
d.相同条件下,若起始向该密闭容器中充入1.0 mol PCl3和0.2 mol Cl2,达到化学平衡状态时,n(PCl5)<0.20 mol
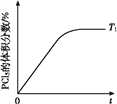
(5)温度T1时,混合气体中PCl5的体积分数随时间t变化的示意图如上。其他条件相同,请在上图中画出温度为T2(T2>T1)时,PCl5的体积分数随时间变化的曲线________。
【答案】 1.2×10-3或0.001 2 0.83或5/6 37.2 abd 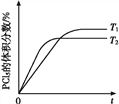
【解析】(1)0~150s内的平均反应速率v(PCl5)= ![]() ==
==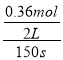 =1.2×10-3mol·L-1s-1,该段时间内v(PCl3)=v(PCl5)=1.2×10-3mol·L-1s-1,故答案为:1.2×10-3;
=1.2×10-3mol·L-1s-1,该段时间内v(PCl3)=v(PCl5)=1.2×10-3mol·L-1s-1,故答案为:1.2×10-3;
(2)开始时c(PCl3)= ![]() =1.0mol/L、c(Cl2)=
=1.0mol/L、c(Cl2)= ![]() =0.5mol/L,平衡时c(PCl5)=
=0.5mol/L,平衡时c(PCl5)= ![]() =0.2mol/L,
=0.2mol/L,
PCl3(g)+Cl2(g) ![]() PCl5(g)
PCl5(g)
开始(mol/L) 1.0 0.5 0
反应(mol/L) 0.2 0.2 0.2
平衡(mol/L) 0.80.3 0.2
化学平衡常数K=![]() =
=![]() =
=![]() ,故答案为:
,故答案为: ![]() ;
;
(3)生成1mol五氯化磷放出93.0kJ热量,250s时生成n(PCl5)=0.40mol放出热量=0.40mol×93.0kJ/mol=37.2kJ,故答案为:37.2;
(4)a.反应前后气体总质量不变、容器体积不变,根据ρ=![]() 知,无论反应是否达到平衡状态密度始终不变,故a正确;b.所有的化学反应只要升高温度正逆反应速率都增大,所以该反应升高温度正逆反应速率都增大,故b正确;c.350s时,向该密闭容器中充入氮气,参加反应的各气体分压不变、浓度不变,则化学平衡不移动,故c错误;d.相同条件下,若起始向该密闭容器中充入1.0molPCl3和0.2molCl2,与原反应相比,相当于减小压强平衡向气体体积增大的方向移动,则生成五氯化磷物质的量小于原来一半,故d正确;故选abd;
知,无论反应是否达到平衡状态密度始终不变,故a正确;b.所有的化学反应只要升高温度正逆反应速率都增大,所以该反应升高温度正逆反应速率都增大,故b正确;c.350s时,向该密闭容器中充入氮气,参加反应的各气体分压不变、浓度不变,则化学平衡不移动,故c错误;d.相同条件下,若起始向该密闭容器中充入1.0molPCl3和0.2molCl2,与原反应相比,相当于减小压强平衡向气体体积增大的方向移动,则生成五氯化磷物质的量小于原来一半,故d正确;故选abd;
(5)该反应的正反应是放热反应,升高温度化学反应速率加快,反应达到平衡时间缩短,但平衡逆向移动,达到平衡时五氯化磷体积分数降低,所以PCl5的体积分数随时间变化的曲线为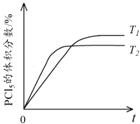 ,故答案为:
,故答案为: 。
。


科目:高中化学 来源: 题型:
【题目】在容积固定的密闭容器中发生反应:Fe(s)+CO2(g) ![]() FeO(s)+CO(g),700 ℃时平衡常数为1. 47,900 ℃时平衡常数为2.15。下列说法正确的是
FeO(s)+CO(g),700 ℃时平衡常数为1. 47,900 ℃时平衡常数为2.15。下列说法正确的是
A.从700 ℃到900 ℃,平衡体系中气体的密度变大
B.该反应的化学平衡常数表达式为K=![]()
C.绝热容器中进行该反应,温度不再变化,则达到化学平衡状态
D.该反应的正反应是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是 ( )。
A. 煤是由有机化合物和无机化合物组成的复杂的混合物
B. 煤是结构复杂的含碳化合物
C. 煤的干馏和木材的干馏发生的都是化学变化,而且干馏产物也相同
D. 煤含有苯和甲苯,可先用干馏,后分馏的方法将它们分离出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【湖北省华中师范大学第一附属中学2017届高三5月押题考试理综化学试题】2011年,麻省理工学院科研团队研发出一种人造树叶,它将一片半导体材料夹在两层特殊的催化剂的中间。若将人造树叶整体浸泡在溶液中,当光照在人造树叶上,就会分解水生成H2和O2,结构如图所示。下列有关人造树叶说法正确的是

A. 该装置最终将太阳能转变为电能
B. Ni、Mo、Zn基催化剂极为阳极,发生氧化反应
C. 可以将人造树叶浸泡在碱性溶液中
D. 钴基催化剂上发生反应:2H2O-4e-=4H++O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用图甲所示装置及器材,测定碳酸钙与盐酸反应生成CO2气体体积随反应时间变化情况,并绘制出图乙所示曲线.有关分析不正确的是( ) 
A.CaCO3与盐酸的反应为放热反应
B.收集气体最多的时间段为t1~t2
C.平均反应速率:v(t1~t2)>v(t2~t3)>v(0~t1)>v(t3~t4)
D.在t4后,收集到的CO2气体不再增加,一定是碳酸钙已完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作,其中正确的是( )
A. 蒸发操作时,应将溶液放入坩埚中加热到出现大量晶体后停止加热
B. 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的底部
C. 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D. 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验Ⅰ:用任氏液(含少量Ca2+)灌注离体蛙心,发现蛙心可持续跳动数小时;实验Ⅱ:用不含Ca2+的任氏液灌注离体蛙心,发现蛙心会很快停止跳动。这两个实验的结果表明Ca2+( )
A.对维持细胞酸碱平衡有重要作用B.对维持生命活动有重要作用
C.对维持蛙心形态有重要作用D.为蛙心的跳动直接提供能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将1.5molA和1.5molB充入3 L容器中,发生反应2A(g)+ B(g)![]() 2C(g),在恒温恒压的条件下反应达平衡状态,此时C的体积分数为40%.试求
2C(g),在恒温恒压的条件下反应达平衡状态,此时C的体积分数为40%.试求
(1)达到平衡时A和B的转化率分别为多少?
(2) 该温度下平衡常数K为多少?
(3)相同温度下, 在容积恒定为2.0 L的密闭容器中同时充入0.75mol A 、0.2mol B、0.75mol C,判断反应是否为平衡状态,若不为平衡状态,将正向还是逆向建立新的平衡?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com