
| A、热稳定性:NaHCO3<Na2CO3 |
| B、与同浓度盐酸反应的剧烈程度:NaHCO3<Na2CO3 |
| C、相同温度时,在水中的溶解性:NaHCO3<Na2CO3 |
| D、等物质的量浓度溶液的pH:NaHCO3<Na2CO3 |
| ||


科目:高中化学 来源: 题型:
| A、根据物质的组成元素是否单一,将纯净物分为单质和化合物 |
| B、根据电解质溶液导电能力强弱,将电解质分为强电解质、弱电解质 |
| C、根据分散系是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 |
| D、根据反应中的能量变化,将化学反应分为氧化还原反应、非氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 滴定次数 | 待测溶液体积/mL | 草酸溶液体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.50 | 23.70 |
| 2 | 25.00 | 1.02 | 26.03 |
| 3 | 25.00 | 0.00 | 24.99 |
| 编号 | 温度/℃ | 酸化的H2C2O4溶液/mL | KMnO4溶液/mL | 溶液褪色时间/s |
| 1 | 25 | 5.0 | 2.0 | 40 |
| 2 | 25 | 5.0(另加少量可溶于水MnSO4粉末) | 2.0 | 4 |
| 3 | 60 | 5.0 | 2.0 | 25 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该物质属于两性氢氧化物 |
| B、该物质是Al(OH)3和Na2CO3的混合物 |
| C、1 mol NaAl(OH)2CO3最多可消耗4 mol H+ |
| D、该药剂适合于胃溃疡患者服用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
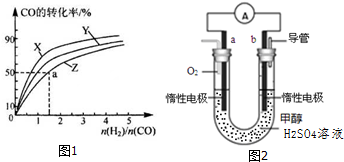
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②①③ | B、③②① |
| C、③①② | D、①②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com