
| A、1:1:2 |
| B、2:1:1 |
| C、1:2:2 |
| D、1:1:1 |


科目:高中化学 来源: 题型:
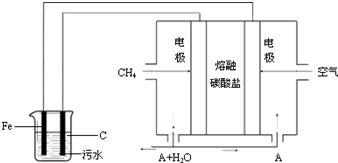 工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用该原理处理污水,设计装置示意图如图所示.
工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用该原理处理污水,设计装置示意图如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3 | B、2.4 |
| C、1.6 | D、4.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 25℃时,向浓度均为0.1mol.L-1的Fe(NO3)3和Al(NO3)3混合溶液中,逐滴加入NaOH溶液,表示生成Al(OH)3的物质的量与加入的NaOH溶液的体积的关系如图所示(已知当离子浓度小于1×10-5mol.L-1时为沉淀完全).则下列说法与判断合理的是( )
25℃时,向浓度均为0.1mol.L-1的Fe(NO3)3和Al(NO3)3混合溶液中,逐滴加入NaOH溶液,表示生成Al(OH)3的物质的量与加入的NaOH溶液的体积的关系如图所示(已知当离子浓度小于1×10-5mol.L-1时为沉淀完全).则下列说法与判断合理的是( )| A、25℃时,Fe(OH)3的溶解度大于Al(OH)3的溶解度 |
| B、25℃时,Fe(OH)3的溶度积大于Al(OH)3的溶度积 |
| C、当生成的Al(OH)3恰好完全溶解时,溶液中的溶质只有NaAlO2 |
| D、图中2a=b=6(c-b) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将煤进行气化处理,提高煤的综合利用效率[ |
| B、大量开采煤、石油,提高产量以满足工业生产的快速发展 |
| C、开发太阳能、水能、风能、可燃冰等新能源,减少使用煤、石油等化石燃料 |
| D、实现资源的“3R”利用观,即:减少资源消耗(Reduce)、增加资源的重复使用(Reuse)、资源的循环再生(Recycle) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:4 | B、1:3 |
| C、1:2 | D、1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某无色溶液中加入酸性KMnO4溶液,溶液紫红色褪去,则该溶液中一定含有Fe2+ |
| B、某气体能使湿润的红色石蕊试纸变蓝,则该气体水溶液一定显碱性 |
| C、某无色溶液中加Ba(NO3)2溶液,再加入稀盐酸,沉淀不溶解,则原溶液中一定有SO42- |
| D、在含有FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热,除去过量的Cl2,即可得到较纯净的FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com