
分析 (1)切开金属钠置于空气中,切口开始呈银白色(钠的真面目)→变暗(生成Na2O)→变白色固体(生成NaOH)→成液(NaOH潮解)→结块(吸收CO2成Na2CO3•10H2O)→最后变成Na2CO3粉(风化);
(2)依据钠的物理性质及钠与水反应产物解答;
(3)反应中铝失去电子化合价升高,硝酸中的氮元素化合价从+5价降为+2价,据此分析氧化剂和还原剂,依据化合价变化结合方程式进行电子转移数目计算.
解答 解:(1)钠性质活泼,易与氧气反应,切开金属钠置于空气中,切口开始呈银白色→变暗→变白色固体→成液→结块→最后变成Na2CO3粉末;
故答案为:A;C;
(2)钠密度小于水,熔点低,浮在水面,钠与水反应生成氢氧化钠和氢气,方程式:2Na+2H2O=2Na++2OH-+H2↑;反应放热,使钠熔化成小球,产生的 氢气推动钠四处游动,
故答案为:BC;2Na+2H2O=2Na++2OH-+H2↑;
(3)Al+4HNO3═Al(NO3)3+NO↑+2H2O,反应中1mol铝失去3mol电子,做还原剂,4mol硝酸中有1mol硝酸中+5价的氮元素化合价降为一氧化氮中+2价,有1mol硝酸做氧化剂,消耗1mol铝转移3mol电子,则有5.4gAl(物质的量为0.2mol)发生反应时,转移电子数为0.6mol;
故答案为:HNO3;1:1;0.6;
点评 本题考查了元素化合物知识,明确钠、硝酸的性质是解题关键,题目难度不大,注意氧化还原分析方法.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
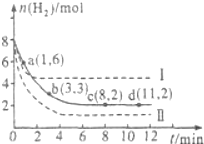 工业上“固定”和利用CO2能有效地减轻“温室”效应,可用CO2生产燃料甲醇:
工业上“固定”和利用CO2能有效地减轻“温室”效应,可用CO2生产燃料甲醇:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH | B. | FeCl3 | C. | Na2CO3 | D. | Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合金的熔沸点比原任一金属要高 | B. | 合金的硬度比原任一金属要大 | ||
| C. | 非金属也可以是合金的成分之一 | D. | 合金的用途比纯金属的用途更广 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室用大理石和稀盐酸制取CO2:2H++CO32-═CO2↑+H2O | |
| B. | 向氯化亚铁溶液滴加新制氯水:2Fe2++Cl2═2Fe3++2Cl- | |
| C. | 向AlCl3溶液中加入过量的NaOH溶液:Al3++3OH-═Al(OH)3↓ | |
| D. | 铁和稀盐酸反应:2Fe+6H+═3H2↑+2Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | 铝比铁活泼 | 通常情况下,铝比铁更容易被腐蚀 |
| B | Fe3+具有氧化性 | 铁盐溶液能净水 |
| C | 与水反应时,钠浮在水面上 | 钠与水反应是放热反应 |
| D | Al2O3的熔点高于Al的熔点 | 铝箔被加热到熔化时,也不滴落下来 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
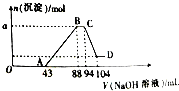 现有一定量铝粉和铁粉的混合物与一定体积稀硝酸充分反应,反应过程中无气体放出(硝酸的还原产物是NH4NO3).在反应结束后的溶液中,逐滴加入2mol?L-1的NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量的关系如图所示.
现有一定量铝粉和铁粉的混合物与一定体积稀硝酸充分反应,反应过程中无气体放出(硝酸的还原产物是NH4NO3).在反应结束后的溶液中,逐滴加入2mol?L-1的NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2溶液中加入过量Al2(SO4)3溶液:3Ba2++6OH-+2Al3++3SO42-═3BaSO4↓+2Al(OH)3↓ | |
| B. | FeCl3溶液中加入少量Na2S溶液:2Fe3++S2-═2Fe2++S↓ | |
| C. | 将适量CO2通入NaClO溶液中(已知次氯酸的K1为2.95×10-8)ClO-+CO2+H2O=HCO3-+HClO | |
| D. | 向Ca(OH)2溶液中加入过量的NaHCO3溶液:Ca2++2HCO3-+2OH-═CO32-+CaCO3↓+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com