
将适量的MO2粉末投入热水中,一边搅拌,一边通入SO2气体,结果得到白色不溶物X,已知X既是氧化产物又是还原产物.下列判断错误的是
①MO2具有氧化性 ②白色不溶物X为MSO2
③白色不溶物X为MSO4 ④白色不溶物X为MS.
A.①② B.③④ C.②④ D.①③
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014-2015上海市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列变化过程中,原物质分子内共价键被破坏,同时有离子键形成的是
A.盐酸和氢氧化钠反应 B.氯化氢溶于水
C.溴化氢和氨反应 D.锌和稀硫酸反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省西安市高三下学期第一次月考理综化学试卷(解析版) 题型:推断题
选考【化学选修5——有机化学基础】(15分)
氯吡格雷(clopidogrel,1)是一种用于抑制血小板聚集的药物,根据原料的不同,该药物的合成路线通常有两条,其中以2氯苯甲醛为原料的合成路线如下:

(1)分子D中的非含氧官能团名称为________________。
(2)D→E的反应类型是________反应。
(3)X的结构简式为____________。
(4)分子C可在一定条件下反应生成一种含有3个六元环的产物,写出该反应的化学方程式________________________________。
(5)A的属于芳香族化合物的所有同分异构体(不包括A)有_____种。
(6)已知: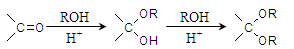
则由乙醇、甲醇为有机原料制备化合物 ,需要经历的反应类型有______(填写编号)。①加成反应 ②消去反应 ③取代反应 ④氧化反应 ⑤还原反应,写出制备化合物
,需要经历的反应类型有______(填写编号)。①加成反应 ②消去反应 ③取代反应 ④氧化反应 ⑤还原反应,写出制备化合物 的最后一步反应_____________。
的最后一步反应_____________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省高三下学期初考试理综化学试卷(解析版) 题型:选择题
现有短周期主族元素X、Y、Z、R、T。R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡。六种元素的原子半径与原子序数的关系如图所示。下列推断正确的是
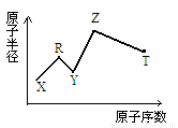
A.原子半径和离子半径均满足:Y<Z
B.氢化物的沸点排序 :Y>T>R
C.最高价氧化物对应的水化物的酸性 :T<R
D.由X、R、Y、Z四种元素组成的化合物水溶液一定显酸性[来源:Z
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广西玉林市博白县高三下学期返校调研考试化学试卷(解析版) 题型:填空题
(14分)“低碳循环”已引起各国家的高度重视,而如何降低大气中CO2的含量和有效地开发利用CO2正成为化学家研究的主要课题。
(1)将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需 | ||
CO | H2O | H2 | CO | |||
1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验2条件下平衡常数K= 。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值_______(填具体值或取值范围)。
③实验4,若900 ℃时,在此容器中加入CO、H2O、CO2 、H2均为1 mol,则此时V正 V逆(填“<”,“>”,“=”)。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g) ΔH=-1275.6 kJ·mol-1
②2CO (g)+ O2(g) = 2CO2(g) ΔH=-566.0 kJ·mol-1
③H2O(g) = H2O(l) ΔH=-44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:____________
(3)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性。常温下,向10 mL 0.01 mol·L-1 H2C2O4溶液中滴加10 mL 0.01 mol·L-1 NaOH溶液时,比较溶液中各种离子浓度的大小关系 ;
(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4 mol·L-1,则生成沉淀所需CaCl2溶液的最小浓度为 ______________mol·L-1。
(5)以二甲醚(CH3OCH3)、空气、H2SO4为原料,铂为电极可构成燃料电池,其工作原理与甲烷燃料电池的原理相似。请写出该电池负极上的电极反应式: 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广西玉林市博白县高三下学期返校调研考试化学试卷(解析版) 题型:选择题
埋在地下的铸铁输油管道,在下列各种情况下,被腐蚀速率最慢的是
A.在潮湿疏松的碱性土壤中
B.在含铁元素较多的酸性土壤中
C.在干燥致密不透气的土壤中
D.在含碳粒较多,潮湿透气的中性土壤中
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省湛江市高三高考测试(一)理综化学试卷(解析版) 题型:实验题
(16分)工业上用难溶于水的碳酸锶(SrCO3)粉末为原料(含少量钡和铁的化合物)制备高纯六水氯化锶晶体(SrCl2·6H2O),其过程为:

已知:Ⅰ.有关氢氧化物沉淀的pH:
氢氧化物 | Fe(OH)3 | Fe(OH)2 |
开始沉淀的pH | 1.5 | 6.5 |
沉淀完全的pH | 3.7 | 9.7 |
Ⅱ.SrCl2·6H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水。
(1)操作①需要加快反应速率,措施有充分搅拌和 (写一种)。
碳酸锶与盐酸反应的离子方程式 。
(2)在步骤②-③的过程中,将溶液的pH值由1调节至 ;宜用的试剂为 。
A.1.5
B.3.7
C.9.7
D.氨水
E.氢氧化锶粉末
F.碳酸钠晶体
(3)操作③中所得滤渣的主要成分是 (填化学式)。
(4)工业上用热风吹干六水氯化锶,适宜的温度是
A.50~60℃ B.80~100℃ C.100℃以上
(5)步骤⑥宜选用的无机洗涤剂是 。
查看答案和解析>>
科目:高中化学 来源:2015年期中备考总动员高三化学模拟卷【福建】3(解析版) 题型:填空题
(16分)NO和NO2是常见的氮氧化物,研究它们的综合利用有重要意义。
(1)氮氧化物产生的环境问题有 (填一种)。
(2)氧化—还原法消除氮氧化物的转化如下:
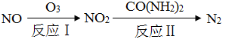
①反应Ⅰ为:NO+O3=NO2+O2,生成11.2 L O2(标准状况)时,转移电子的物质的量是 mol。
②反应Ⅱ中,当n(NO2)∶n[CO(NH2)2]=3∶2时,反应的化学方程式是 。
(3)硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:
NO2(g)+SO2(g) SO3(g)+NO(g) △H=-41.8 kJ·mol-1
SO3(g)+NO(g) △H=-41.8 kJ·mol-1
①已知:2SO2(g)+O2(g) 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1
写出NO和O2反应生成NO2的热化学方程式 。
②一定温度下,向2 L恒容密闭容器中充入NO2和SO2各1 mol,5min达到平衡,此时容器中NO 和NO2的浓度之比为3∶1,则NO2的平衡转化率是 。
③上述反应达平衡后,其它条件不变时,再往容器中同时充入
NO2、SO2、SO3、NO各1mol,平衡 (填序号)。
A.向正反应方向移动
B.向逆反应方向移动
C.不移动
(4)某化学兴趣小组构想将NO转化为HNO3,装置如图,电极为多孔惰性材料。则负极的电极反应式是 。
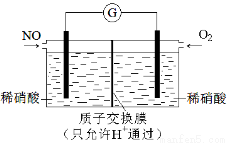
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com