
【题目】下列叙述正确的是( )
A.生成物总能量一定低于反应物总能量
B.酒精可用作燃料,说明酒精燃烧是放热反应
C.硝酸铵溶于水温度降低,这个变化是吸热反应
D.同温同压下,H2和Cl2在光照和点燃条件下的ΔH不同
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某温度下,将浓度都是0.1mol·L-1的X2、Y2两种气体充入至密闭容器中,使之发生反应生成气体Z,达到平衡时c(X2)=0.04mol·L-1、c(Y2)=0.08mol·L-1、c(Z)=0.04mol·L-1,则该反应的反应式是
A. X2+2Y2![]() XY2 B. 3X2+Y2
XY2 B. 3X2+Y2![]() 2X3Y
2X3Y
C. 2X2+Y2![]() 2X2Y D. X2+3Y2
2X2Y D. X2+3Y2![]() 2XY3
2XY3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修5:有机化学基础】
1,6—己二酸(G)是合成尼龙的主要原料之一,可用烃A氧化制备。制备G的合成路线如下:

回答下列问题:
(1)写出化合物C的系统命名_________ ;化合物A通过质谱测得相对分子质量为82,则A的化学名称为__________。
(2)C→D的反应类型为__________。
(3)F的结构简式为__________。
(4)写出能同时满足下列条件的X的同分异构体的结构简式___________。
①相对分子质量与F相等
②烃的含氧衍生物,能发生银镜反应
③核磁共振氢谱中有三组峰,面积比为3:2:1
(5)由G合成尼龙的化学方程式为__________。
(6)由A通过两步反应制备1,3-环己二烯的合成路线为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关的离子方程式书写正确的是
A. 向铜片中滴加浓硫酸并加热,有刺激性气味气体产生:Cu+4H++SO42-![]() Cu2++SO2↑+2H2O
Cu2++SO2↑+2H2O
B. 服用阿司匹林过量出现水杨酸(![]() )中毒反应,可静脉注滴NaHCO3溶液:
)中毒反应,可静脉注滴NaHCO3溶液:![]() +2HCO3-→
+2HCO3-→![]() +2CO2↑+2H2O
+2CO2↑+2H2O
C. 20mL1.0mol/L的明矾溶液与10mL3.5mol/L Ba(OH)2溶液混合充分反应:3Ba2++6OH-+2Al3++3SO42-=3BaSO4↓+2Al(OH)2↓
D. 向Ca(HCO3)2溶液中加入过量NaOH溶液,有白色沉淀生成:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某可逆反应mA(g)+nB(g)![]() pC(g),在密闭容器中进行,如图表示在不同反应时间t、温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线,由曲线分析,下列判断正确的是( )
pC(g),在密闭容器中进行,如图表示在不同反应时间t、温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线,由曲线分析,下列判断正确的是( )

A.T1<T2、P1>P2、m+n>p,△H<0
B.T1>T2、P1<P2、m+n>p,△H>0
C.T1>T2、P1<P2、m+n<p,△H>0
D.T1<T2、P1>P2、m+n<p,△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016年北京Ⅰ卷】以Na2SO3溶液和不同金属的硫酸盐溶液作为实验对象,探究盐的性质和盐溶液间反应的多样性。
实验 | 试剂 | 现象 | |
滴管 | 试管 | ||
2 mL | 0.2 mol·L1 Na2SO3溶液 | 饱和Ag2SO4溶液 | Ⅰ.产生白色沉淀 |
0.2 mol·L1 CuSO4溶液 | Ⅱ.溶液变绿,继续滴加产生棕黄色沉淀 | ||
0.1 mol·L1 Al2(SO4)3溶液 | Ⅲ.开始无明显变化,继续滴加产生白色沉淀 | ||
(1)经检验,现象Ⅰ中的白色沉淀是Ag2SO3。用离子方程式解释现象Ⅰ: 。
(2)经检验,现象Ⅱ的棕黄色沉淀中不含SO42,含有Cu+、Cu2+和SO32。已知:Cu+![]() Cu +Cu2+,Cu2+
Cu +Cu2+,Cu2+![]() CuI↓(白色)+I2。
CuI↓(白色)+I2。
①用稀硫酸证实沉淀中含有Cu+的实验现象是 。
②通过下列实验证实,沉淀中含有Cu2+和SO32。
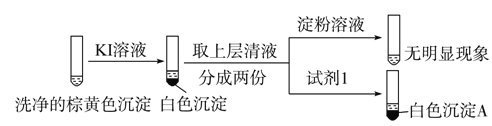
a.白色沉淀A是BaSO4,试剂1是 。
b.证实沉淀中含有Cu2+和SO32的理由是 _。
(3)已知:Al2(SO4)3在水溶液中不存在。经检验,现象Ⅲ的白色沉淀中无SO42,该白色沉淀既能溶于强酸,又能溶于强碱,还可使酸性KMnO4溶液褪色。
①推测沉淀中含有亚硫酸根和 。
②对于沉淀中亚硫酸根的存在形式提出两种假设:i.被Al(OH)3所吸附;ii.存在于铝的碱式盐中。对假设ii设计了对比实验,证实了假设ii成立。
a.将对比实验方案补充完整。
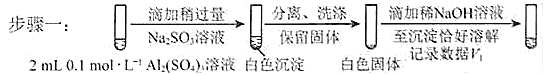
步骤二: (按上图形式呈现)。
(4)根据实验,亚硫酸盐的性质有 。盐溶液间反应的多样性与 有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.现有下列8种物质:①Na2CO3、②NaHCO3、③HCl、④NH4HCO3、⑤C2H5OH、⑥Al、⑦食盐水、⑧CH3COOH。
(1)上述物质中属于强电解质的是________(填序号),既能跟盐酸反应又能跟NaOH溶液反应的是____________(填序号)
(2)上述②的水溶液呈碱性的原因是(用离子方程式表示)___________________
II.(1)物质的量浓度相同的 ①氯化铵;② 碳酸氢氨;③ 硫酸氢氨; ④硫酸氨4种溶液中,c(NH4+)由大到小的顺序是___________
(2)请写出明矾做净水剂净水时的离子方程式_________________
(3) CH3COOH溶液中存在电离平衡:CH3COOH![]() CH3CH3COO﹣+H+ △H>0 ,下列方法中,可以使0.10mol·L﹣1CH3COOH溶液中CH3COOH电离程度增大的是
CH3CH3COO﹣+H+ △H>0 ,下列方法中,可以使0.10mol·L﹣1CH3COOH溶液中CH3COOH电离程度增大的是
a.加入少量0.10mol·L﹣1的稀盐酸
b.加热
c.加水稀释至0.010mol·L﹣1
d.加入少量冰醋酸
e.加入少量氯化钠固体
f.加入少量0.10mol·L﹣1的NaOH溶液
(4) 等物质的量浓度的下列物质的溶液:①NaCl②CH3COONa ③NH4Cl ④AlCl3 ⑤Ba(OH)2 ⑥Na2CO3 ⑦NaHCO3 ⑧NaHSO4 ⑨NaOH ⑩H2SO4 pH值由大到小的顺序是 (填序号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)==2SO3(g)反应过程中的能量变化如下图所示。
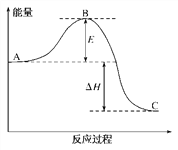
已知1mol SO2(g)氧化为1mol SO3(g)的ΔH=-99 kJ·mol-1
请回答下列问题:
(1)图中A、C分别表示__________的能量、___________的能量;
(2)图中ΔH=______________________;
(3)已知单质硫的燃烧热为-296 kJ·mol-1,计算由S(s)生成3mol SO3(g)ΔH=___________;
(4)化学反应的焓变与反应物和生成物的键能有关。
已知:①H2(g)+Cl2(g)=2HCl(g) ΔH=-185 kJ·mol-1
②H—H键能为436kJ·mol-1,Cl—Cl键能为247kJ·mol-1。则H—Cl键能为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 二氧化氯可用于自来水的杀菌消毒
B. 铝制餐具不宜用来蒸煮或长时间存放咸的食物
C. 把固体炸药制成胶体能提高威力
D. 做焰色反应时透过蓝色钴玻璃观察到紫色的现象说明待测液中一定含有钾盐
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com