
| A. | CuO→Cu | B. | Fe→Fe2+ | C. | H2SO4→SO2 | D. | H2O2→O2 |
科目:高中化学 来源: 题型:选择题
| A. | 水泥、玻璃、水晶饰物都是硅酸盐制品 | |
| B. | 用澄清石灰水鉴别SO2 和CO2 | |
| C. | 将Fe(NO3)2 溶于稀盐酸,滴加KSCN 溶液没有颜色变化 | |
| D. | 透闪石的化学成分为Ca2Mg5Si8O22(OH)2 写成氧化物的形式为:2CaO•5MgO•8SiO2•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | A | B | D | E | G | H | I | J |
| 化合价 | -1 | -2 | +4、-4 | +4、-2 | +5、-3 | +3 | +2 | +1 |
| 原子半径/nm | 0.071 | 0.074 | 0.077 | 0.102 | 0.110 | 0.143 | 0.160 | 0.186 |
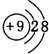 .
.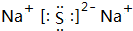 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只含有1个双键的直链有机物 | B. | 含有2个双键的直链有机物 | ||
| C. | 含有1个双键的环状有机物 | D. | 含有1个叁键的直链有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na与水反应 Na+2H2O═Na++2OH-+H2↑ | |
| B. | 向AlCl3溶液中加入过量的NaOH溶液 Al3++3OH-═Al(OH)3↓ | |
| C. | 氢氧化钡溶液与硫酸溶液反应 Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | CO2通入过量澄清石灰水 CO2+Ca2++2OH-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 放热反应在常温下一定很容易发生 | |
| C. | 反应是放热还是吸热,取决于反应物和生成物所具有的总能量的相对大小 | |
| D. | 在一定条件下,某可逆反应正向是吸热反应,则其逆向必是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.35 mol/L | B. | 8.70 mol/L | C. | 10.05 mol/L | D. | 11.40 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com