
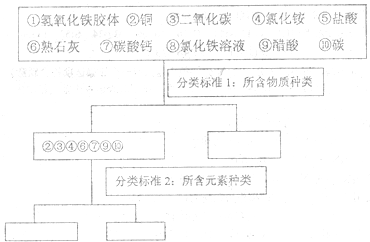
分析 (1)物质按照物质种类的多少可分为纯净物和混合物,纯净物按照所含元素种类的多少又可分为单质和化合物,含有一种元素的纯净物是单质,含有不同元素的纯净物是化合物;
(2)胶体具有丁达尔效应而溶液不具备;
(3)溶洞形成的原理是碳酸根和水二氧化碳反应生成溶于水的碳酸氢钙,在另一地方受热,压强等因素的影响分解生成碳酸钙的过程.
解答 解:(1)物质按照物质种类的多少可分为纯净物和混合物,如②、③、④、⑥、⑦、⑨、⑩,种类只有一种,为纯净物,①为胶体属于混合物、⑤属于氯化氢分散在水中形成的混合物、⑧为氯化铁和水的混合物,含有一种元素的纯净物是单质,如②、⑩,含有不同元素的纯净物是化合物,如:③、④、⑥、⑦、⑨,
故答案为:①⑤⑧;②⑩;③④⑥⑦⑨;
(2)氢氧化铁胶体具有丁达尔效应,而溶液不具备该性质,可以做丁达尔实验来区分,实验方法为:分别取样做丁达尔实验,出现丁达尔效应的是氢氧化铁胶体,
故答案为:分别取样做丁达尔实验,出现丁达尔效应的是氢氧化铁胶体;
(3)溶洞形成的原理是碳酸根和水二氧化碳反应生成溶于水的碳酸氢钙,CaCO3+H2O+CO2=Ca(HCO3)2,在另一地方受热,压强等因素的影响分解,Ca(HCO3)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCO3+H2O+CO2↑生成碳酸钙的过程,上述物质中参与了自然界溶洞形成的是二氧化碳和碳酸钙即③⑦;
故答案为:③⑦.
点评 本题是对物质分类、胶体的性质以及自然界溶洞形成等知识的考查,掌握相关概念以及相应的基础知识是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ②③④⑤⑥ | C. | ②③⑤⑥⑦ | D. | ①②⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O、BaSO4、O2 | B. | FeCl2 溶液、Fe 粉、Cl2 | ||
| C. | H2O、CaCO3、SO3气体 | D. | H2O、SiO2、HCl 气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
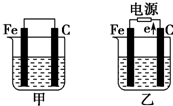 如图所示,甲、乙是电化学实验装置,请回答下列问题:
如图所示,甲、乙是电化学实验装置,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
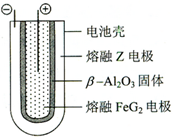 X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.
X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.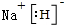 ;五种元素中非金属气态氢化物还原性最强的是H2S(写化学式).
;五种元素中非金属气态氢化物还原性最强的是H2S(写化学式). Fe+2ZG放电时,电池的正极反应式为Fe2++2e-=Fe:充电时,钠(写物质名称)电极接电源的负极.
Fe+2ZG放电时,电池的正极反应式为Fe2++2e-=Fe:充电时,钠(写物质名称)电极接电源的负极.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
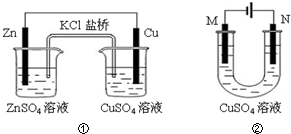
| A. | 装置①中盐桥内的K+移向ZnSO4溶液 | |
| B. | 若装置②中N极为铁棒,M极为石墨,则铁棒不易被腐蚀 | |
| C. | 若装置②用于铁棒镀铜,则M极为铁棒 | |
| D. | 若装置②用于电解精炼铜,则溶液中Cu2+浓度保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于12.5% | B. | 大于12.5% | C. | 小于12.5% | D. | 无法确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com