
| A. |  所示装置制取并观察Fe(OH)2 | |
| B. | 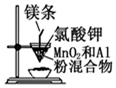 所示装置制取金属锰 | |
| C. |  所示装置配制100 mL 0.1 mol•L-1 硫酸溶液 | |
| D. |  所示装置比较N、C、Si的非金属性强弱 |
分析 A.四氯化碳的密度比水密度大,在下层;
B.点燃Mg条,引发铝热反应,冶炼高熔点的金属;
C.容量瓶不能用来稀释溶液;
D.稀硝酸易挥发,硝酸与硅酸钠反应.
解答 解:A.四氯化碳的密度比水密度大,在下层,则不能防止生成的氢氧化亚铁被氧化,应选苯隔绝空气,故A错误;
B.点燃Mg条,引发铝热反应,冶炼高熔点的金属,则图中装置可制取金属锰,故B正确;
C.容量瓶不能用来稀释溶液,应在烧杯中稀释,故C错误;
D.稀硝酸易挥发,硝酸与硅酸钠反应,则不能比较碳酸、硅酸的酸性及非金属性,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握实验装置的作用、物质的制备和性质实验、溶液配制方法、非金属性比较为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | B元素的简单气态氢化物与E的氢化物化合,生成物的水溶液呈酸性 | |
| B. | B、C、E最高价氧化物对应的水化物溶液均能与D元素的氧化物反应 | |
| C. | 元素B、E分别与元素A构成的含有18个电子的分子中均含有非极性共价键 | |
| D. | 最高价氧化物对应水化物的碱性:C>D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论或解释 |
| A | 将稀盐酸滴入加有酚酞的Na2SiO3溶液中,边加边震荡, | 红色变浅并接近消失 | 有硅酸胶体生成 |
| B | 氯化钠晶体导电实验 | 不导电 | 晶体不存在离子 |
| C | AgI悬浊液中滴入Na2S溶液 | 固体变黑 | Ksp(Ag2S)>Ksp(AgI) |
| D | 测量H2CO3的电离常数 | Ka1>ka2 | H2CO3一级电离常数产生的H+对二级电离起抑制作用 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 甲图为一种新型污水处理装置,该装置可利用一种微生物将有机废水的化学能直接转化为电能.乙图是一种家用环保型消毒液发生器,用惰性电极电解饱和食盐水.下列说法中不正确的是( )
甲图为一种新型污水处理装置,该装置可利用一种微生物将有机废水的化学能直接转化为电能.乙图是一种家用环保型消毒液发生器,用惰性电极电解饱和食盐水.下列说法中不正确的是( )| A. | N电极上每消耗22.4L气体(标准状况)时,则有4molH+通过质子交换膜从负极区移向正极区 | |
| B. | 若装置乙所需的电能来自装置甲,则b极应与X 极连接 | |
| C. | 若有机废水中主要含有葡萄糖,则装置甲中M极发生的电极应为C6H12O6+6H2O-24e-=6CO2↑+24H+ | |
| D. | 由装置乙制得的家用消毒液的主要成分是NaClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向FeI2溶液中滴加少量氯水,反应的离子方程式为:2Fe2++Cl2═2Fe3++2Cl- | |
| B. | 能使pH试纸显深红色的溶液中,Fe3+、Cl-、Ba2+、Br-,能够大量共存 | |
| C. | 向NaClO溶液中通入少量二氧化碳的离子方程式:2ClO-+CO2+H2O═2HClO+CO32- | |
| D. | 向溴水中加入足量氯化亚铁溶液能使溴水变成无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ | |
| NaCl | 35.7 | 35.8 | 36.0 | 36_3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | -① | - | - | - |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径大小:M<N<Q<R | |
| B. | W中的阴阳离子个数比为1:1,属于离子化合物 | |
| C. | Q的某单质可作水的消毒剂,该单质在大气中含量越多,对人体越有益 | |
| D. | M和N、Q均能形成既含极性键又含非极性键的分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | B. | 2CH3CH2OH+O2$\stackrel{Cu,△}{→}$2CH3CHO+2H2O | ||
| C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HClO是弱酸,所以NaClO是弱电解质 | |
| B. | 浓硫酸的脱水性属物理性质,相应的变化过程是物理变化 | |
| C. | 二氧化硫能使滴有酚酞的氢氧化钠溶液褪色,体现了漂白性 | |
| D. | 氯气能使湿润的淀粉碘化钾试纸变蓝 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com