
| A. | 离子键是指阴阳离子间的静电引力 | |
| B. | 离子化合物是指只含有离子键的化合物 | |
| C. | 升高温度只能使吸热反应的速率增大,不能使放热反应的速率增大 | |
| D. | 粉碎固体反应物可以增大反应速率 |
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.5mol•L-1•s-1 | B. | v(D)=0.2mol•L-1•s-1 | ||
| C. | v(C)=0.25mol•L-1•s-1 | D. | v(B)=0.3mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
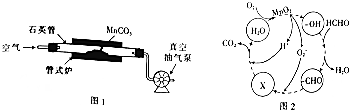
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
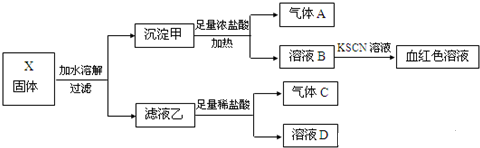
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/mol•L-1 | c(H2SO4)/mol•L-1 |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.1 | 0.2 |
| ③ | 50 | 0.2 | 0.1 |
| ④ | 50 | 0.1 | 0.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 羊毛、棉花、淀粉都是自然界存在的天然高分子化合物 | |
| B. | 生物炼铜的原理是利用某些具有特殊本领的细菌把不溶性的硫化铜转化为铜离子 | |
| C. | 某反应的△H>0、△S<0,则该反应一定不能正向进行 | |
| D. | 为加快漂白精的漂白速率,使用时可滴加几滴醋酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com