
分析 中和热是强酸强碱发生反应生成1mol水放出的热量,据此书写热化学方程式,1mol的稀硫酸含有2molH+,全部反应生成2mol水,由此分析解答.
解答 解:在通常状况下,足量氢氧化钠的稀溶液与含溶质为1mol的稀硫酸完全反应时放出akJ的热量,1mol的稀硫酸含有2molH+,全部反应生成2mol水,生成1mol水放热$\frac{a}{2}$KJ,中和热的热化学方程式为:NaOH(aq)+$\frac{1}{2}$H2SO4(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-$\frac{a}{2}$kJ/mol;
故答案为:NaOH(aq)+$\frac{1}{2}$H2SO4(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-$\frac{a}{2}$kJ/mol.
点评 本题考查了中和热的热化学方程式的书写知识,较基础,学生注意培养阅读材料获取信息的能力.


科目:高中化学 来源: 题型:填空题
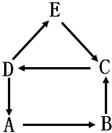 A、B、C、D、E为初中化学常见物质,A是单质,其余为化合物.E可用于检验气体B,它们之间有如图所示的转化关系(“→”表示生成,部分反应物、生成物、反应条件已省略).回答下列问题:
A、B、C、D、E为初中化学常见物质,A是单质,其余为化合物.E可用于检验气体B,它们之间有如图所示的转化关系(“→”表示生成,部分反应物、生成物、反应条件已省略).回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
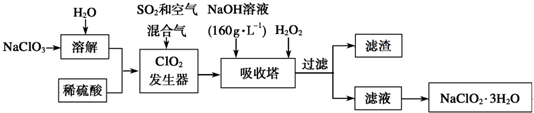
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl | B. | NaCl NaBr | C. | NaCl NaBr NaI | D. | NaCl NaI |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制Fe(NO3)2溶液时,为了防止Fe2+水解可向溶液中加入适量的稀硝酸 | |
| B. | 向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,则Ksp(BaCO3)<Ksp(BaSO4) | |
| C. | pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 | |
| D. | 已知I2可溶于KI形成KI3,向两支盛有KI3溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀,说明KI3溶液中存在平衡:I3-?I2+I- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
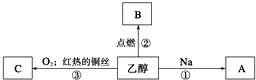
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应已经停止 | B. | 逆反应速率为0 | ||
| C. | 体系温度不再改变 | D. | N2O5已全部转化为NO2和O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com