
 2Fe+Al2O3: 焊接铁轨
2Fe+Al2O3: 焊接铁轨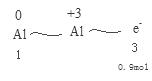


科目:高中化学 来源:不详 题型:单选题
 2K2SO4+2Al2O3 +9SO2 +48H2O,下列判断正确的是
2K2SO4+2Al2O3 +9SO2 +48H2O,下列判断正确的是| A.在焙烧明矾的反应中,还原剂与氧化剂的物质的量之比是3:4 |
| B.最后得到的K2SO4溶液呈中性,所以c(K+)=c(SO42-) |
| C.焙烧产生的SO2可用于制硫酸,焙烧948 t明矾(M=" 474" g/mol),若SO2的利用率为96%,可生产质量分数为98%的硫酸432 t |
| D.工业上冶炼Al2O3制得Al,以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是 |
 NaAlO2+3Ni(OH)2
NaAlO2+3Ni(OH)2查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①② | B.②③⑤ | C.①②④⑤ | D.全部 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 8Cu+4FeO+2Fe2O3+16SO2反应制取铜及其硫和铁的化合物。
8Cu+4FeO+2Fe2O3+16SO2反应制取铜及其硫和铁的化合物。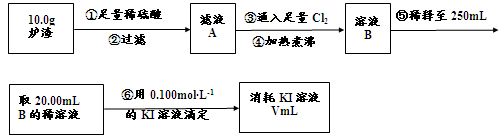
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 操作正确且能达到目的的是
操作正确且能达到目的的是| A.将NaOH溶液缓慢滴入MgSO4溶液中,观察Mg(OH)2沉淀的生成 |
| B.将水加入浓硫酸中得到稀硫酸,置镁片于其中探究讨Mg的活泼性 |
| C.将Mg(OH)2浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀 |
| D.将Mg(OH)2沉淀转入表面皿中,加足量稀盐酸,加热蒸干得无水MgCl2固体 |
查看答案和解析>>
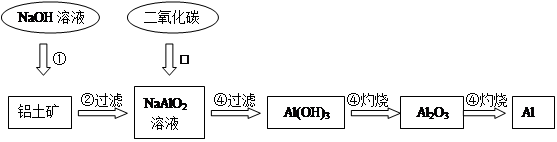
科目:高中化学 来源:不详 题型:填空题
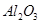 ,含
,含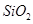 、
、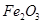 等杂质)中提取氧化铝的工艺做实验,流程如下:
等杂质)中提取氧化铝的工艺做实验,流程如下: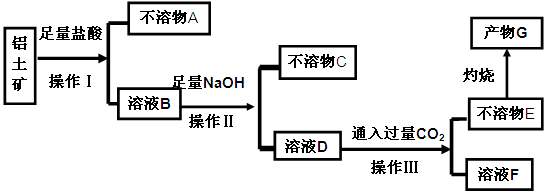
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
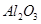 ,含
,含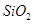 、
、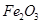 、MgO等杂质)中提取两种工艺品的流程如下:
、MgO等杂质)中提取两种工艺品的流程如下: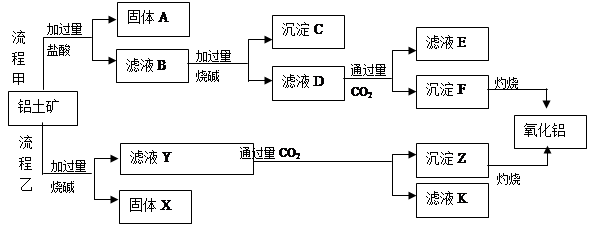
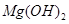 的溶度积常数
的溶度积常数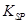 =10-11,取适量的滤液B,加入一定量的烧碱恰使镁离子沉淀完全,则溶液的PH最小为_______.
=10-11,取适量的滤液B,加入一定量的烧碱恰使镁离子沉淀完全,则溶液的PH最小为_______.查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
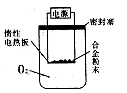
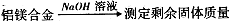 。
。
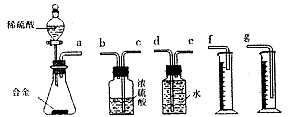
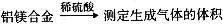 。
。
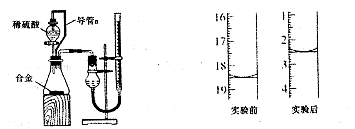
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com