
【题目】室温下向20mL含0.10mol·L-1Cr2+和0.10mol·L-1Fe2+的混合溶液中滴加0.10 mol·L -1NaOH溶液,金属阳离子浓度与滴入NaOH溶液体积的关系曲线如图所示。若溶液中金属离子浓度小于10-5mol·L-1视为完全沉淀,则下列说法错误的是
[Cr(OH)2的ksp为2×10-16,Fe(OH)2的ksp为8×10-16]

A. 曲线A表示c(Fe2+)
B. 当V(NaOH)=30mL时,Fe2+开始沉淀
C. 当pH=7时溶液中Fe2+、Cr2+均完全沉淀
D. V(NaOH)>30mL时,溶液中c(Fe2+)︰c(Cr2+) =4.0
【答案】C
【解析】
根据Cr(OH)2的ksp为2×10-16,若使Cr2+沉淀完全,c(OH-)=![]() =2
=2![]() 10-6mol/L,
10-6mol/L,
同理根据Fe(OH)2的ksp为8×10-16,若使Fe2+沉淀完全,c(OH-)=![]() =4
=4![]() 10-6mol/L,故Cr2+先沉淀完全,由图可知曲线A表示c(Fe2+),曲线B表示c(Cr2+),以此解答。
10-6mol/L,故Cr2+先沉淀完全,由图可知曲线A表示c(Fe2+),曲线B表示c(Cr2+),以此解答。
根据Cr(OH)2的ksp为2×10-16,若使Cr2+沉淀完全,c(OH-)=![]() =2
=2![]() 10-6mol/L,
10-6mol/L,
同理根据Fe(OH)2的ksp为8×10-16,若使Fe2+沉淀完全,c(OH-)=![]() =4
=4![]() 10-6mol/L,故Cr2+先沉淀完全,由图可知曲线A表示c(Fe2+),曲线B表示c(Cr2+),
10-6mol/L,故Cr2+先沉淀完全,由图可知曲线A表示c(Fe2+),曲线B表示c(Cr2+),
A. 由以上分析可知,曲线A表示c(Fe2+),故A正确;
B. 由于Cr(OH)2的ksp小于Fe(OH)2的ksp,Cr(OH)2先沉淀,当V(NaOH)=30mL时,A曲线出现拐点,此时c(Fe2+)=0.1mol/L![]() =0.04mol/L,开始沉淀,故B正确;
=0.04mol/L,开始沉淀,故B正确;
C. 根据前面分析中的计算结果可知,Fe2+、Cr2+完全沉淀时的溶液c(OH-)均大于10-7mol/L,所以当pH=7时溶液中Fe2+、Cr2+均未完全沉淀,故C错误;
D. V(NaOH)>30mL时,Fe2+、Cr2+都处于沉淀溶解平衡,所以溶液中c(Fe2+)︰c(Cr2+) =![]() =
=![]() =4.0,故D正确。
=4.0,故D正确。
故选C。


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 图1表示1 L pH=2的CH3COOH溶液加水稀释至V L,pH随lg V的变化
B. 图2表示不同温度下水溶液中H+和OH-浓度的变化的曲线,图中温度T2<T1
C. 图3表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率等于b点
D. 图4表示同一温度下,相同物质的量BaO2在不同容积的容器中进行反应:2BaO2(s)![]() 2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g)![]() CO(g)+H2(g)在一体积可变的容器中进行。下列条件的改变对其化学反应速率几乎没有影响的是:①增加C的用量;②将容器体积缩小一半;③保持容器体积不变,充入氮气使容器内压强增大;④保持压强不变,充入氮气使容器的体积变大
CO(g)+H2(g)在一体积可变的容器中进行。下列条件的改变对其化学反应速率几乎没有影响的是:①增加C的用量;②将容器体积缩小一半;③保持容器体积不变,充入氮气使容器内压强增大;④保持压强不变,充入氮气使容器的体积变大
A. ②④ B. ①③ C. ③④ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氧气的反应:2H2O2=2H2O+O2↑下列条件下,反应的速率最快的是( )
选项 | H2O2的质量分数 | 温度 | 催化剂 |
A | 5% | 5℃ | MnO2 |
B | 5% | 40℃ | MnO2 |
C | 10% | 5℃ | 无 |
D | 10% | 40℃ | MnO2 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏伽德罗常数的值。下列叙述正确的是
A. 1 mol Na2O2晶体中共含有4NA个离子
B. 标准状况下,22.4LCH3OH含有NA个分子
C. 常温下,1LpH=1的H2SO4溶液中,含有0.2NA个H+
D. 标准状况下,22.4LN2和O2的混合气体中含有的原子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. 已知:
反应Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常数为K1;
FeO(s)+CO(g)的平衡常数为K1;
反应Fe(s)+H2O(g)![]() FeO(s)+H2(g)的平衡常数为K2。
FeO(s)+H2(g)的平衡常数为K2。
在不同温度时K1、K2的值如下表:
温度(绝对温度) | K1 | K2 |
973 | 1.47 | 2.38 |
1173 | 2.15 | 1.67 |
(1)推导反应CO2(g)+H2(g)![]() CO(g)+H2O(g)的平衡常数K与K1、K2的关系式:___________,判断该反应是___________反应(填“吸热”或“放热”)。
CO(g)+H2O(g)的平衡常数K与K1、K2的关系式:___________,判断该反应是___________反应(填“吸热”或“放热”)。
II. T1温度下,体积为 2L的恒容密闭容器,加入4.00molX,2.00molY,发生化学反应 2X(g)+Y(g)![]() 3M(g)+N(s) △H<0。部分实验数据如表格所示。
3M(g)+N(s) △H<0。部分实验数据如表格所示。
t/s | 0 | 500 | 1000 | 1500 |
n(X)/mol | 4.00 | 2.80 | 2.00 | 2.00 |
(2)前500s反应速率v(M)=____________,该反应的平衡常数K=_____________。
(3)该反应达到平衡时某物理量随温度变化如下图所示。纵坐标可以表示的物理量有哪些_____。

a.Y的逆反应速率 b.M的体积分数
c.混合气体的平均相对分子质量 d.X的质量分数
(4)反应达到平衡后,若再加入3.00molM,3.00molN,下列说法正确的是_____。
A.平衡不移动
B.重新达平衡后,M的体积分数小于50%
C.重新达平衡后,M的物质的量浓度是原平衡的1.5倍
D.重新达平衡后,Y的平均反应速率与原平衡相等
E.重新达平衡后,用X表示的v(正)比原平衡大
(5)若容器为绝热恒容容器,起始时加入4.00molX,2.00molY,则达平衡后M的物质的量浓度_____1.5mol/L(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)与氢气或与水在催化剂作用下的反应如下:
Ⅰ.COS(g)+H2(g)![]() H2S(g)+CO(g) △H1=-17kJ/mol;
H2S(g)+CO(g) △H1=-17kJ/mol;
Ⅱ.COS(g)+H2O(g)![]() H2S(g)+CO2(g) △H2=-35kJ/mol。
H2S(g)+CO2(g) △H2=-35kJ/mol。
回答下列问题:
(1)两个反应在热力学上趋势均不大,其原因是:________________。
(2)反应CO(g)+H2O(g)![]() H2(g)+CO2(g)的△H=_______。
H2(g)+CO2(g)的△H=_______。
(3)羰基硫、氢气、水蒸气共混体系初始投料比不变,提高羰基硫与水蒸气反应的选择性的关键因素是______。
(4)在充有催化剂的恒压密闭容器中只进行反应Ⅰ![]() 设起始充入的n(H2):n(COS)=m,相同时间内测得COS转化率与m和温度(T)的关系如图所示:
设起始充入的n(H2):n(COS)=m,相同时间内测得COS转化率与m和温度(T)的关系如图所示:

①m1______m2(填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() 。
。
②温度高于T0,COS转化率减小的可能原因为:i有副应发生;ii______;iii______。
(5)在充有催化剂的恒压密闭容器中进行反应Ⅱ.COS(g)与H2O(g)投料比分别为1:3和1:1,反应物的总物质的量相同时,COS(g)的平衡转化率与温度的关系曲线如图所示:
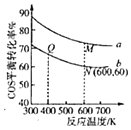
①M点对应的平衡常数______Q点![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() ;
;
②N点对应的平衡混合气中COS(g)物质的量分数为______;
③M点和Q点对应的平衡混合气体的总物质的量之比为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】螺环化合物具有抗菌活性,用其制成的药物不易产生抗药性,螺[3,4]辛烷的结构如图,下列有关螺[3,4]辛烷的说法正确的是( )

A. 分子式为C8H16B. 分子中所有碳原子共平面
C. 与2—甲基—3—庚烯互为同分异构体D. 一氯代物有4种结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com