

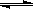 CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
 CO2(g)+2H2O(l) △H1=—890KJ.mol-1
CO2(g)+2H2O(l) △H1=—890KJ.mol-1  CO32-+ 7H2O;
CO32-+ 7H2O;  CO2(g)+2H2O(l) △H1=—890KJ.mol-1
CO2(g)+2H2O(l) △H1=—890KJ.mol-1  CO32-+ 7H2O;
CO32-+ 7H2O;

科目:高中化学 来源:不详 题型:填空题
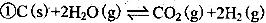
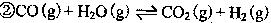

 其相关数据如下表所示:
其相关数据如下表所示:

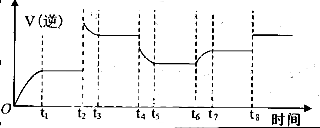
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.已知CO的燃烧热为283 kJ/mol,2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ/mol,则图甲表示CO和H2O(g)生成CO2和H2的能量变化 |
| B.某温度下,pH=11的NH3·H2O和pH=1的盐酸等体积混合后(不考虑混合后溶液体积的变化)恰好完全反应,反应后的溶液中NH4+ 、NH3·H2O与NH3三种微粒的平衡浓度之和为0.05 mol·L-1 |
| C.在常温下,X2(g)和H2反应生成HX的平衡常数如表所示,仅依据K的变化,就可以说明在相同条件下,平衡时X2(从F2到I2)的转化率逐渐降低,且X2与H2反应的剧烈程度逐渐减弱 |
D.图乙中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中, 的变化情况 的变化情况 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-1068 kJ/mol |
| B.肼是与氨类似的弱碱,它易溶于水,其电离方程式:N2H4 + H2O=N2H5++ OH- |
| C.铂做电极,以KOH溶液为电解质溶液的肼—空气燃料电池,放电时的负极反应式:N2H4-4e-+4OH-=N2↑+4H2O |
| D.铂做电极,以KOH溶液为电解质溶液的肼—空气燃料电池,工作一段时间后,KOH溶液的pH将增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
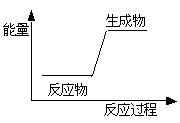
| A.生石灰加水生成熟石灰 |
| B.C+H2O=CO+H2 |
| C.金属钠与水反应 |
| D.HNO3+NaOH=NaNO3+H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.-1780kJ/mol | B.-1220 kJ/mol | C.-450 kJ/mol | D.+430 kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.50 mol·L-1盐酸,0.50 mol·L-1NaOH溶液,100 mL量筒1个 |
| B.0.50 mol·L-1盐酸,0.55 mol·L-1NaOH溶液,100 mL量筒2个 |
| C.0.50 mol·L-1盐酸,0.55 mol·L-1NaOH溶液,50 mL量筒1个 |
| D.0.50 mol·L-1盐酸,0.55 mol·L-1NaOH溶液,50 mL量筒2个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com