
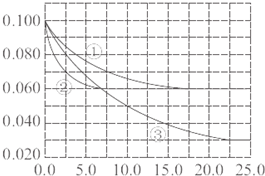
 在一定温度下,将1molCO与3molH2气体充入一体积不变的密闭容器中,在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)=CH3OH(g)
在一定温度下,将1molCO与3molH2气体充入一体积不变的密闭容器中,在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)=CH3OH(g)| 实验编号 | T(℃) | n(CO)/n(H2) | p(MPa) |
| ⅰ | 150 | 1/3 | 0.1 |
| ⅱ | 5 | ||
| ⅲ | 350 | 5 |
| 总质量 |
| 体积 |
| 实验编号 | T(℃) | n(CO)/n(H2) | p(MPa) |
| ⅰ | |||
| ⅱ | 150 | 1/3 | |
| ⅲ | 1/3 |


科目:高中化学 来源: 题型:
| A、该元素的同主族的元素的原子,最外层电子数相同,但化学性质差异很大 |
| B、该元素位于长周期,且该周期中有32种元素 |
| C、该元素的阴离子能与铁离子共存 |
| D、该元素为53号元素,其相对原子量为127,则该元素的一种原子中必定含有74个中子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:2 | B、1:4 |
| C、大于1:4 | D、小于1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
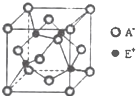 己知A、B、C、D、E、F六种元素均位于前四周期,其有关结构或性质信息如表所示:
己知A、B、C、D、E、F六种元素均位于前四周期,其有关结构或性质信息如表所示:| 元素 | 有关结构或性质信息 |
| A | A的某同位素原子的质子数与中子数相等,应用于核聚变反应 |
| B | 其最高价氧化物的水化物是强酸,能与其氢化物反应生成盐 |
| C | 基态原子核外s能级上的电子数是p能级上电子数的2倍 |
| D | 所组成的单质和氢化物中分别有一种具有漂白性 |
| E | E+离子的各层电子均充满,E2+离子与BA3形成的离子水溶液呈深蓝色 |
| F | F3+基态离子的能级为半充满结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | H+、NH4+、Mg2+、Ba2+、Al3+ |
| 阴离子 | OH-、Cl-、HCO3-、NO3-、SO42- |
| AgNO3溶液 |
| 稀HNO3 |
| 实验步骤 | 预期现象和结论 |
| 去C的溶液于试管中, |
预期现象和结论1: 预期现象和结论2: |
查看答案和解析>>
科目:高中化学 来源: 题型:
 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com