
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 名称 | 次氯酸 | 磷酸 | 硫酸 | 高氯酸 |
| 结构式 | Cl-OH | 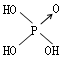 |
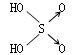 |
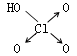 |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
元素代号 | X | Y | Z | L | M | Q |
原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.077 | 0.074 |
主要化合价 | +2 | +3 | +6、-2 | +7、-1 | +4、-4 | -2 |
下列说法中,正确的是
A.在化学反应中,M原子既不容易失去电子,又不容易得到电子
B.等物质的量的X、Y的单质与足量盐酸反应,生成H2一样多
C.Y与Q形成的化合物不可能跟氢氧化钠溶液反应
D.Z的氢化物的稳定性强于L的氢化物的稳定性
查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建省泉州一中高一下学期期中考试化学试卷(带解析) 题型:填空题
(18分)下表为元素周期表中的一部分,表中列出了11种元素在周期表中的位置,按要求完成下列各小题。
(1) 化学性质最不活泼的元素是 (填元素符号或化学式,下同),
非金属性最强的元素是 。
金属性最强的单质与水反应的离子方程式是
。
(2) ①③⑤三种元素的最高价氧化物对应的水化物中,碱性最强的化合物的化学式是
(3) ①②③三种元素的原子半径由大到小的顺序是 > > 。
(4) 某元素的最高价氧化物对应的水化物既能与酸反应生成盐和水,又能和碱反应
生成盐和水,该元素的最高价氧化物和盐酸反应的离子方程式为
。
向该元素和⑧号元素形成的化合物的溶液中,缓慢滴加氨水至过量,产生的实验现象是 ,有关反应的化学方程式为 。(5)⑥元素形成的单质与浓硝酸发生化学反应的化学方程式为
。
查看答案和解析>>
科目:高中化学 来源:2014届福建省高一下学期期中考试化学试卷(解析版) 题型:填空题
(18分)下表为元素周期表中的一部分,表中列出了11种元素在周期表中的位置,按要求完成下列各小题。

(1) 化学性质最不活泼的元素是 (填元素符号或化学式,下同),
非金属性最强的元素是 。
金属性最强的单质与水反应的离子方程式是
。
(2) ①③⑤三种元素的最高价氧化物对应的水化物中,碱性最强的化合物的化学式是
(3) ①②③三种元素的原子半径由大到小的顺序是 > > 。
(4) 某元素的最高价氧化物对应的水化物既能与酸反应生成盐和水,又能和碱反应
生成盐和水,该元素的最高价氧化物和盐酸反应的离子方程式为
。
向该元素和⑧号元素形成的化合物的溶液中,缓慢滴加氨水至过量,产生的实验现象是 ,有关反应的化学方程式为 。(5)⑥元素形成的单质与浓硝酸发生化学反应的化学方程式为
。
查看答案和解析>>
科目:高中化学 来源: 题型:
元素代号 | X | Y | Z | L | M | Q |
原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.077 | 0.074 |
主要化合价 | +2 | +3 | +6、-2 | +7、-1 | +4、-4 | -2 |
下列说法中,正确的是
A.在化学反应中,M原子既不容易失去电子,又不容易得到电子
B.等物质的量的X、Y的单质与足量盐酸反应,生成H2一样多
C.Y与Q形成的化合物不可能跟氢氧化钠溶液反应
D.Z的氢化物的稳定性强于L的氢化物的稳定性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com