
下列说法正确的是:
A.在100 ℃、101 kPa条件下,液态水的气化热为40.69 kJ·mol-1,则H2O(g) H2O(l) 的ΔH =" 40.69" kJ·mol-1 H2O(l) 的ΔH =" 40.69" kJ·mol-1 |
| B.已知MgCO3的Ksp =" 6.82" × 10-6,则所有含有固体MgCO3的溶液中,都有 c(Mg2+) = c(CO32-),且c(Mg2+) · c(CO32-) =" 6.82" × 10-6 |
C.已知: 则可以计算出反应  的ΔH为-384 kJ·mol-1 的ΔH为-384 kJ·mol-1 |
| D.常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使NH3·H2O的电离度降低,溶液的pH减小 |
D
解析试题分析:物理变化没有反应热,A不正确;B不正确,例如将碳酸镁放在在氯化镁溶液中c(Mg2+)和c(CO32-)不相等,且只有当达到溶解平衡时才能满足c(Mg2+) · c(CO32-)=6.82 × 10-6。C不正确,因为苯环中不存在碳碳双键和碳碳单键,因此根据表中数据不能计算该反应的反应热;D中增大NH4+的浓度,抑制氨水的电离,溶液的酸性增强,答案选D。
考点:考查反应热的判断和计算、溶度积常数的判断和应用、外界条件对电离平衡的影响
点评:该题是高考中的常见题型和考点,属于中等难度试题的考查。试题难易适中,综合性强,在注重对学生基础知识巩固和训练的同时,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和应试能力。


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
(2013?徐州模拟)某温度下,反应2A(g)
|
查看答案和解析>>
科目:高中化学 来源: 题型:
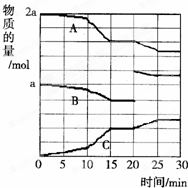 在实验室中做下列实验:把物质A、B按一定比例充入一个表面积为300cm2,容积为2L的球形容器,使压强为P,然后将整个容器用加热器加热到t℃时,发生如下反应:
在实验室中做下列实验:把物质A、B按一定比例充入一个表面积为300cm2,容积为2L的球形容器,使压强为P,然后将整个容器用加热器加热到t℃时,发生如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 |
IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 1 | A | ||||||
| 2 | B | C | D | E | J | K | L |
| 3 | F | G | H | I | |||
| M |
 它的空间利用率为
它的空间利用率为查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 碳是形成化合物最多的元素.
碳是形成化合物最多的元素.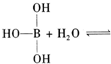
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com