
| A. | L层上的电子数为奇数的原子不一定是主族元素的原子 | |
| B. | 只由共价键形成的物质不一定是共价化合物 | |
| C. | 化学键的形成一定伴随着电子的转移和能量变化 | |
| D. | 元素周期表中,位于金属和非金属分界线附近的元素属于过渡元素 |
分析 A.原子的L层上的电子数为奇数的元素,说明L层为填充满电子,元素为锂、硼、氮、氟;
B、仅由共价键形成的化合物是共价化合物;
C、化学键的形成一定伴随着能量的变化,但不一定有电子转移;
D.元素周期表中位于金属和非金属分界线附近的元素属于半导体元素.
解答 解:A.L层电子为奇数的所有元素为锂、硼、氮、氟,均为主族元素,故A错误;
B、仅由共价键形成的化合物是共价化合物,而不是物质,物质可能是单质,如氢气分子中存在氢氢共价键,但不是化合物,故B正确;
C、化学键的形成一定伴随着能量的变化,但不一定有电子转移,故C错误;
D.元素周期表中位于金属和非金属分界线附近的元素属于半导体元素,而不是过渡元素,故D错误;
故选B.
点评 本题考查元素周期律,题目难度不大,熟悉元素在周期表中的位置及元素的性质即可解答,注意同期表中的特殊元素.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
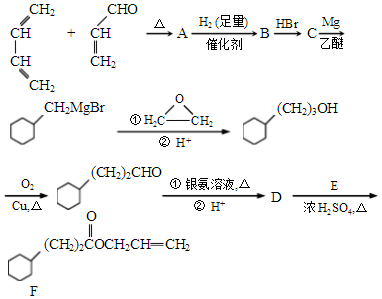
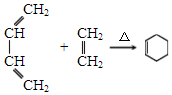
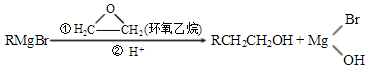
 ,A中所含官能团的名称是醛基、碳碳双键.
,A中所含官能团的名称是醛基、碳碳双键. .
.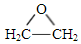 )为原料制备1丁醇,设计合成路线
)为原料制备1丁醇,设计合成路线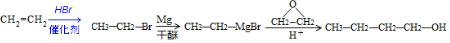 (其它试剂任选).(合成路线常用表示方法为:A $→_{反应条件}^{反应试剂}$ B …$→_{反应条件}^{反应试剂}$目标产物)
(其它试剂任选).(合成路线常用表示方法为:A $→_{反应条件}^{反应试剂}$ B …$→_{反应条件}^{反应试剂}$目标产物)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 编号 | A(KMnO4溶液浓度/mol•L-1) | B(草酸溶液浓度/mol•L-1) | C(硫酸溶液浓度/mol•L-1) | 褪色时间/s |
| 1 | 3 | 3 | 1 | 336 |
| 2 | 1 | 2 | 3 | 82 |
| 3 | 3 | 1 | 3 | 76 |
| 4 | 1 | 3 | 2 | 133 |
| 5 | 2 | 3 | 3 | 102 |
| 6 | 3 | 2 | 2 | 156 |
| 7 | 2 | 2 | 1 | 300 |
| 8 | 2 | 1 | 2 | 115 |
| 9 | 1 | 1 | 1 | 200 |
| A(KMnO4溶液) | B(草酸溶液) | C(硫酸溶液) | |||||||
| 浓度/mol•L-1 | 0.005 | 0.010 | 0.015 | 0.1 | 0.5 | 0.9 | 6 | 12 | 18 |
| 平均褪色时间/s | 138.3 | 172.3 | 189.3 | 130.3 | 179.3 | 190.3 | 278.7 | 134.7 | 86.7 |
| c(H2SO4)/mol•L-1 | 18 | 16 | 14 | 12 | 10 | 8 | 6 |
| 褪色时间/s | 67 | 83 | 90 | 103 | 129 | 146 | 200 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
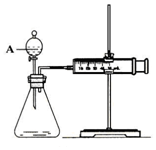 用如图所示的装置来测定镁与硫酸反应的速率,在锥形瓶中加入0,7克镁带,按图连接好装置,从A中加入20.0ml0.5mol/LH2SO4.记录注射器活塞的位置和相应的时间.记录数据如表
用如图所示的装置来测定镁与硫酸反应的速率,在锥形瓶中加入0,7克镁带,按图连接好装置,从A中加入20.0ml0.5mol/LH2SO4.记录注射器活塞的位置和相应的时间.记录数据如表| 时间/s | 0 | t | 2t | … |
| 活塞的位置/ml | 17.3 | 25.6 | 36.6 | … |
| 实验序号 | 双氧水体积/mL | 蒸馏水体积/mL | 添加的物质 |
| 1 | 10 | 0 | 4mLFeCl3 |
| 2 | 10 | 2 | 2mLCuCl2 |
 .
.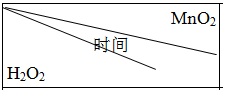 | 0.1g | 0.3g | 0.8g |
| 10mL1.5% | 223s | 67s | 36s |
| 10mL3.0% | 308s | 109s | 98s |
| 10mL4.5% | 395s | 149s | 116s |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 副族元素中没有非金属 | |
| B. | 除短周期外,其他周期均有18种元素 | |
| C. | ⅠA族的所有元素都为金属元素 | |
| D. | 同周期ⅡA族与ⅢA族元素原子序数相差只有1、11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
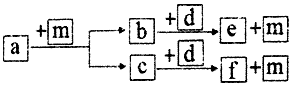 短周期元素W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f是由这些元素组成的化合物,d是淡黄色粉末,m为元素Y的单质,通常为无色无味的气体.上述物质的转化关系如图所示.下列说法错误的是( )
短周期元素W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f是由这些元素组成的化合物,d是淡黄色粉末,m为元素Y的单质,通常为无色无味的气体.上述物质的转化关系如图所示.下列说法错误的是( )| A. | 简单离子半径:Z>Y | |
| B. | Z2Y2中既含有离子键又含有共价键,其中阳离子和阴离子的比值为2:1 | |
| C. | 简单气态氢化物的热稳定性:Y>X | |
| D. | 由上述4种元素组成的化合物属于离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使甲基橙变红的溶液中:Fe2+、Al3+、NO3-、Cl- | |
| B. | 在pH=12的溶液中:Na+、AlO2-、NO3-、S2- | |
| C. | 室温下,由水电离的c(H+)=10-10mol/L的溶液中:Cl-、HCO3-、NO3-、NH4+ | |
| D. | 加入Mg能放出H2的溶液中:Mg2+、NH4+、ClO-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)═c(HCO3-)+c(CO32-)+c(H2CO3) | B. | c(Na+)+c(H+)═c(HCO3-)+2c(CO32-)+c(OH-) | ||
| C. | HCO3-的电离程度小于其水解程度 | D. | c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com