
| 操作 | 可能的实验现象 | 解释 | |
| A | 某溶液中加入盐酸酸化的氯化钡溶液 | 有白色沉淀生成 | 溶液中一定含有SO42- |
| B | 将SO2中通入硝酸钡溶液中 | 有白色沉淀生成 | BaSO3不溶于硝酸 |
| C | 同温同压下,用pH试纸测定相同浓度的碳酸钠和硫酸钠溶液的酸碱性 | 碳酸钠溶液显碱性,硫酸钠溶液显中性 | 碳酸钠发生了水解 |
| D | 向淀粉KI溶液中通入Cl2 | 溶液先变蓝后褪色 | Cl2先表现氧化性、后表现强氧化性 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.白色沉淀可能为AgCl;
B.二氧化硫能被硝酸钡氧化生成硫酸根离子,硫酸根离子和钡离子反应生成硫酸钡沉淀;
C.强酸强碱盐不发生水解,强碱弱酸盐能发生水解反应;
D.氯气和次氯酸都具有强氧化性,但氯气没有漂白性、次氯酸有漂白性.
解答 解:A.白色沉淀可能为AgCl,则应先加盐酸无现象,再加氯化钡检验硫酸根离子,实验的解释应为溶液中可能含有SO42-,或含银离子,但二者不能同时存在,故A错误;
B.二氧化硫能被硝酸钡氧化生成硫酸根离子,硫酸根离子和钡离子反应生成硫酸钡沉淀,所以生成的白色沉淀是硫酸钡而不是亚硫酸钡,故B错误;
C.强酸强碱盐不发生水解,强碱弱酸盐能发生水解反应,硫酸钠不发生水解则硫酸钠溶液呈中性,碳酸钠中碳酸根离子水解导致碳酸钠溶液呈碱性,故C正确;
D.氯气和次氯酸都具有强氧化性,但氯气没有漂白性、次氯酸有漂白性,氯气氧化碘离子生成碘,氯气和水反应生成的次氯酸导致溶液褪色,故D错误;
故选C.
点评 本题考查化学方案评价,为高频考点,侧重考查学生分析判断能力,涉及离子检验、氧化还原反应、盐类水解等知识点,明确元素化合物性质、化学反应原理等知识点是解本题关键,易错选项是BD.


科目:高中化学 来源: 题型:选择题
 ”和“
”和“ ”分别表示不同的原子.下列对此反应的分类一定不正确的是( )
”分别表示不同的原子.下列对此反应的分类一定不正确的是( )
| A. | 化合反应 | B. | 可逆反应 | C. | 置换反应 | D. | 氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制取蒸馏水时,为了防止瓶内产生暴沸现象,应先向烧瓶内加入几片碎瓷片 | |
| B. | 稀释浓硫酸时,常把水加入到盛浓硫酸的烧杯中 | |
| C. | 做CO还原Fe2O3实验时,为防止CO污染环境,实验完毕,常先停止通CO,再停止加热 | |
| D. | 进行硫酸铜溶液的浓缩结晶实验需要的仪器主要有烧杯、玻璃棒、蒸发皿 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过滤操作中,漏斗下端要紧靠烧杯内壁,而分液操作中,无此要求 | |
| B. | 蒸馏操作时,应使温度计水银球插入蒸馏烧瓶的溶液中 | |
| C. | 蒸发操作时,应用玻璃棒不断搅拌待有大量晶体出现,停止搅拌,继续把水份蒸干 | |
| D. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
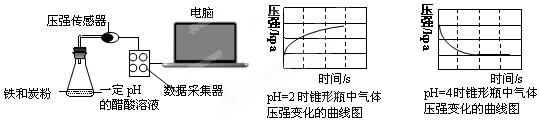
| A. | 溶液pH≤2时,生铁发生析氢腐蚀 | |
| B. | 生铁的腐蚀中化学腐蚀比电化学腐蚀更普遍 | |
| C. | 在酸性溶液中生铁可能发生吸氧腐蚀 | |
| D. | 两溶液中负极反应均为:Fe-2e-═Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同主族元素形成的单质熔沸点自上而下逐渐升高 | |
| B. | 核外电子排布相同的微粒化学性质一定相同 | |
| C. | 同主族元素最高价含氧酸的酸性随核电荷数的增加而减弱 | |
| D. | 非金属元素的气态氢化物的稳定性越强其沸点就越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
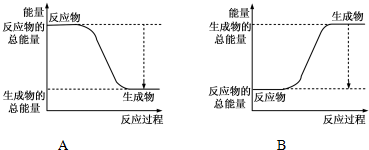
| 化学键 | H-H | O=O | H-O |
| 键能kJ/mol | 436 | 496 | 463 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com