
【题目】对于可逆反应:mA(g)+nB(?)![]() xC(g) △H,在不同温度及压强(p1,p2)条件下,反应物A的转化率如图所示,下列判断正确的是
xC(g) △H,在不同温度及压强(p1,p2)条件下,反应物A的转化率如图所示,下列判断正确的是
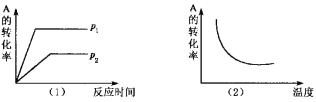
A. △H >0,m+n>x,同时B为非气态
B. △H >0,m+n<x,同时B为气态
C. △H <0,m+n>x,同时B为气态
D. △H <0,m<x,同时B为非气态
【答案】C
【解析】根据图(1)到达平衡时所用时间的长短判断压强p1和p2的相对大小,增大压强,化学平衡向气体体积减小的方向移动,由此判断反应前后气体化学计量数的相对大小;根据图(2)判断,升高温度,化学平衡向吸热方向移动,再结合A的转化率判断该反应的正反应是放热还是吸热。
由图(1)知,p2到达平衡时所用时间长,p1到达平衡时所用时间短,所用压强为p2的反应速率慢,为p1的反应速率快,压强越大反应速率越大,所以p2<p1;增大压强,化学平衡向气体体积减小的方向移动,由图象知,A的转化率增大,平衡向正反应方向移动,所以反应前的计量数大于反应后的计量数,当B为气态,即m+n>x,当B为非气态时,即m>x;图(2)知,随着温度的升高,A的转化率减低,平衡向逆反应方向移动,升高温度,平衡向吸热反应方向移动,所以逆反应方向是吸热反应,正反应是放热反应,即△H<0,只有C符合;
答案选C。


 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:
【题目】按下列四种有关性质的叙述,可能属于金属晶体的是( )
A. 由分子间作用力结合而成,熔点低
B. 固体或熔融后易导电,熔点在1000 ℃左右
C. 由共价键结合成网状结构,熔点高
D. 固体和熔融状态不导电,但溶于水后可能导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. HClO是弱酸,所以NaClO是弱电解质
B. 0.1 mol·L-1CH3COOH溶液的pH>1,可知CH3COOH溶液中存在CH3COOH![]() CH3COO-+H+
CH3COO-+H+
C. 能导电的物质一定是电解质
D. 弱电解质的电离程度越大,导电能力越强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子或离子中都存在着配位键的是( )
A.NH3、H2O B.NH4+、H3O+ C.N2、HClO D.[Cu(NH3)4]2+、PCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
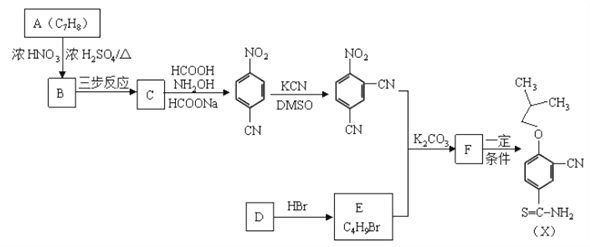
【题目】有机物X是合成抗痛风药非布司他的一种中间体,其合成路线如下图所示:
已知: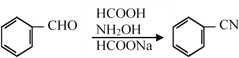
(1)A是一种重要的化工原料和有机溶剂,其结构简式是________。
(2)A![]() B的反应类型是________。
B的反应类型是________。
(3)C中所含的官能团是________。
(4)B![]() C可通过三步反应完成,请选择必要的无机试剂完成该转化,写出有关反应的化学方程式________、________、________。
C可通过三步反应完成,请选择必要的无机试剂完成该转化,写出有关反应的化学方程式________、________、________。
(5)D是一种烃,D![]() E时可能产生的副产物结构简式是________。
E时可能产生的副产物结构简式是________。
(6)F与![]() 在一定条件下反应生成X,写出F的结构简式________。
在一定条件下反应生成X,写出F的结构简式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除去杂质的方法正确的是
物质 | 杂质 | 试剂 | 主要操作 | |
A | NaHCO3 | Na2CO3 | ---- | 灼烧 |
B | SiO2 | Fe2O3 | 盐酸 | 过滤 |
C | KBr溶液 | Br2 | KOH溶液 | 分液 |
D | Cl2 | HCl | 饱和碳酸钠溶液 | 洗气 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯氧磷(化学式:POCl3)常用作半导体掺杂剂及光导纤维原料。氯化水解法生产三氯氧磷的流程如下:

⑴氯化水解法生产三氯氧磷的化学方程式为______。
⑵通过佛尔哈德法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
Ⅰ.取ag产品于锥形瓶中,加入足量NaOH溶液,待完全水解后加稀硝酸至酸性。
Ⅱ.向锥形瓶中加入0.1000 mol·L-1的AgNO3溶液40.00 mL,使Cl-完全沉淀。
Ⅲ.向其中加入2 mL硝基苯,用力摇动,使沉淀表面被有机物覆盖。
Ⅳ.加入指示剂,用cmol·L-1NH4SCN溶液滴定过量Ag+至终点,记下所用体积。
已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12
①滴定选用的指示剂是______(选填字母),滴定终点的现象为______。
a.NH4Fe(SO4)2 b.FeCl2 c.甲基橙 d.淀粉
②实验过程中加入硝基苯的目的是_____________________,如无此操作所测Cl元素含量将会______(填“偏大”、“偏小”或“不变”)
⑶氯化水解法生产三氯氧磷会产生含磷(主要为H3PO4、H3PO3等)废水。在废水中先加入适量漂白粉,再加入生石灰调节pH将磷元素转化为磷酸的钙盐沉淀并回收。
①在沉淀前先加入适量漂白粉的作用是_________________。
②下图是不同条件对磷的沉淀回收率的影响图像。
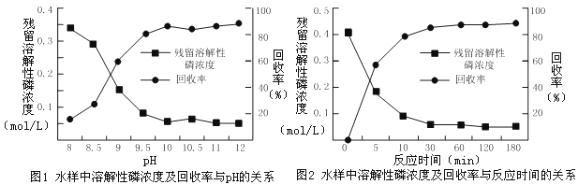
处理该厂废水最合适的工艺条件为______(选填字母)。
a.调节pH=9 b.调节pH=10 c.反应时间30 min d.反应时间120 min
③若处理后的废水中c(PO43-)=4×10-7mol·L-1,溶液中c(Ca2+)=__________mol·L-1。
(已知Ksp[Ca3(PO4)2]=2×10-29)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)丙烷是一种优良的燃料,下图是一定量丙烷完全燃烧生成CO2和1 mol H2O(l)过程中的能量变化图。试回答下列问题:

①写出表示丙烷燃烧热的热化学方程式:_________________________。
②二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔。1 mol二甲醚完全燃烧生成CO2和液态水放出1 455 kJ的热量。若1 mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1 645 kJ的热量,则混合气体中,丙烷和二甲醚的物质的量之比为_________________。
(2)盖斯定律认为:不管化学反应是一步完成或分步完成的,整个过程的总热效应相同。试运用盖斯定律回答下列问题:
已知:H2O(g)H2O(l) ΔH1=-Q1kJ·mol-1
C2H5OH(g)C2H5OH(l) ΔH2=-Q2kJ·mol-1
C2H5OH(g)+3O2(g)2CO2(g)+3H2O(g) ΔH3=-Q3kJ·mol-1
若使23 g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为________kJ。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com