
【题目】草酸钴是制作氧化钴和金属钴的原料。一种利用含钴废料(主要成分为Co2O3,含少量Fe2O3、Al2O3、CaO、MgO、碳及有机物等)制取CoC2O4的工艺流程如图:
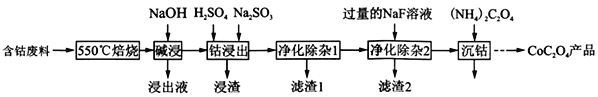
(1)“550℃焙烧”的目的是_____________________________。
(2)“浸出液”的主要成分是__________________。
(3)“钴浸出”过程中Co3+转化为Co2+,该反应的离子方程式为_________________________。
(4)“净化除杂1”过程中,先在40~50℃加入H2O2,再升温至80~85℃,加入Na2CO3溶液,调pH至4.5,“滤渣1”主要成分的是__________________。
(5)“净化除杂2”可将钙、镁离子转化为沉淀过滤除去,若所得滤液中c(Ca2+)=1.0×l0-6mol/L,则滤液中c(Mg2+)为__________________。[已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10]
(6)为测定制得样品的纯度,现称取1.000g样品,将其用适当试剂转化,得到草酸铵溶液,再用过量稀硫酸酸化,用0.1000mol/LKMnO4溶液滴定,达到滴定终点时,共用去KMnO4溶液24.00mL,则草酸钴样品的纯度为___________。
(7)取一定质量的CoC2O4·2H2O分解后的钴氧化物(Co的化合价为+2、+3),用480ml 5mol/L盐酸恰好完全溶解固体,得到CoCl2溶液和4.48L(标准状况)黄绿色气体。试确定该钴氧化物中Co、O的物质的量之比为___________。
【答案】除去碳和有机物 NaAlO2 2Co3++SO32-+H2O=2Co2++SO42-+2H+ Fe(OH)3 7.0×10-7mol/L 88.2% 5:6
【解析】
(1)“550℃焙烧”的目的,应从含钴废料中含有碳和有机物进行分析;
(2)“浸出液”的主要成分,应为含钴废料中的某物质与碱反应的产物;
(3)“钴浸出”过程中Co3+转化为Co2+,则发生Co3+与SO32-反应,生成SO42-、Co2+等;
(4)“净化除杂1”过程中,先在40~50℃加入H2O2,再升温至80~85℃,加入Na2CO3溶液,调pH至4.5,“滤渣1”主要成分是Fe3+水解的产物;
(5)先利用Ksp(CaF2)=1.05×10-10,求出c2(F-),再由Ksp(MgF2)=7.35×10-11,求出c(Mg2+);
(6)利用电子守恒,建立关系式2MnO4-——5C2O42-——5CaC2O4,n(CaC2O4)=![]() n(MnO4-),从而求出草酸钴样品的纯度;
n(MnO4-),从而求出草酸钴样品的纯度;
(7)利用关系式O——2H+,Co2+——2Cl-,可分别求出Co、O原子的物质的量,从而求出该钴氧化物中Co、O的物质的量之比。
(1)“550℃焙烧”的目的,是从含钴废料中除去碳和有机物;
答案为:除去碳和有机物;
(2)“浸出液”的主要成分,为含钴废料中Al2O2与NaOH反应的产物NaAlO2;
答案为:NaAlO2;
(3)“钴浸出”过程中Co3+转化为Co2+,则发生Co3+与SO32-反应,生成SO42-、Co2+等,离子方程式为2Co3++SO32-+H2O=2Co2++SO42-+2H+;
答案为:2Co3++SO32-+H2O=2Co2++SO42-+2H+;
(4)“净化除杂1”过程中,先在40~50℃加入H2O2,再升温至80~85℃,加入Na2CO3溶液,调pH至4.5,“滤渣1”主要成分是Fe3+水解的产物Fe(OH)3;
(5) Ksp(CaF2)=1.05×10-10,c2(F-)=![]() =1.05×10-5mol/L;Ksp(MgF2)=7.35×10-11,c(Mg2+)=
=1.05×10-5mol/L;Ksp(MgF2)=7.35×10-11,c(Mg2+)=![]() =7.0×10-7mol/L;
=7.0×10-7mol/L;
答案为:7.0×10-7mol/L;
(6)利用电子守恒,建立关系式2MnO4-——5C2O42-——5CaC2O4,n(CaC2O4)=![]() n(MnO4-)=
n(MnO4-)=![]() ×0.1000mol/L×0.024mL=0.006mol,从而求出草酸钴样品的纯度
×0.1000mol/L×0.024mL=0.006mol,从而求出草酸钴样品的纯度![]() = 88.2%;
= 88.2%;
答案为:88.2%;
(7)利用关系式O——2H+,Co2+——2Cl-,可求出n(Co)= ![]() (5mol/L×0.48L-
(5mol/L×0.48L-![]() )=1mol,n(O)=
)=1mol,n(O)=![]() ×5mol/L×0.48L=1.2mol,从而得出n(Co):n(O)=1mol:1.2mol=5:6;
×5mol/L×0.48L=1.2mol,从而得出n(Co):n(O)=1mol:1.2mol=5:6;
答案为:5:6。


科目:高中化学 来源: 题型:
【题目】依据下列甲、乙、丙三图判断,下列叙述不正确的是
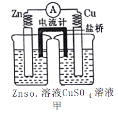
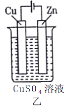
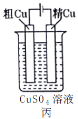
A.甲是原电池,乙是电镀装置
B.甲、乙装置中,锌极上均发生氧化反应
C.乙、丙装置中,阳极均发生氧化反应而溶解
D.丙装置中,若粗铜中含有Au、Ag、Fe、Zn等杂质,电解后Au、Ag形成阳极泥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辉铜矿的主要成分是Cu2S,含较多的Fe2O3、SiO2杂质:软锰矿的主要成分是MnO2,含有较多的SiO2杂质。辉铜矿的湿法冶炼,目前国内外都处于探索之中。自氧化还原氨分离法是一种较为理想的湿法冶炼方法,工艺流程如下:

回答下列问题:
(1)“浸出”时,为提高矿石的浸出率,下列措施可采取的是________。(填标号)
A 适当提高浸出温度 B 适当延长浸出时间 C 增大矿石的粒度
(2)将100g辉铜矿和40g 98%的浓硫酸混合,在80~90℃条件下浸出2.5h,铜的浸出率随软锰矿用量的变化如下:

则浸出100g辉铜矿,软锰矿的最适宜用量为_____g。
(3)“浸出”后的浸出液中含有CuSO4、MnSO4、Fe2(SO4)3等溶质,“滤渣I”中含有淡黄色固体单质,则“浸出”时产生淡黄色固体的化学方程式为__________________________。
(4)研究表明矿物中Fe2O3在“浸出”反应中起着重要的媒介作用,促进Cu2S与MnO2的溶解,其反应过程如下:
①Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
②Cu2S+2Fe2(SO4)3=2CUSO4+4FeSO4+S↓;
③___________________________________。(写出反应的化学方程式)
(5)“滤渣II”的主要成分是______________;“沉锰”后,得到的深蓝色溶液中除NH4+、H+外,还含有的阳离子为__________。(写化学式)
(6)“滤液III”经结晶可得到(NH4)2SO4晶体。结晶时,当________时,即可停止加热。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将仪器A中的浓盐酸滴加到盛有MnO2的烧瓶中,加热后产生的气体依次通过装置B和C,然后再通过加热的石英玻璃管D(放置有铁粉)。请回答下列问题:
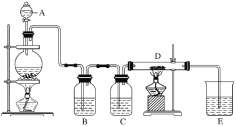
(1)仪器A的名称是________,烧瓶中反应的化学方程式是___________。
(2)装置B中盛放液体是_______,气体通过装置B的目的是___________。
装置C中盛放的液体是________,气体通过装置C的目的是____________。
(3)D中反应的化学方程式是__________________。
(4)烧杯E中盛放的液体是________,反应的化学方程式是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,X、Y、Q、W 都是惰性电极,将电源接通后,W极附近颜色逐渐加深。下列说法中不正确的是

A.电源的M 极为正极
B.甲装置中溶液的pH 减小
C.甲装置的两个电极上都有单质生成且物质的量之比为1︰1
D.欲用乙装置给铜镀银,U 极应该是Ag,电镀液选择AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,NOx和SO2是雾霾的主要成分。
Ⅰ.NOx主要来源于汽车尾气,可以利用化学方法将二者转化为无毒无害的物质。
已知:N2(g)+O2(g)![]() 2NO(g) ΔH=+196 kJ·mol-1
2NO(g) ΔH=+196 kJ·mol-1
2CO(g)+O2(g) ![]() 2CO2(g) ΔH=-554 kJ·mol-1
2CO2(g) ΔH=-554 kJ·mol-1
(1)请写出NO和CO转变为两种无毒无害的物质的热化学方程式_______________。
(2)T℃时,将等物质的量的NO和CO充入容积为2 L的密闭容器中,保持温度和体积不变,反应过程(0~15 min)中NO物质的量随时间变化如图所示。
①已知:平衡时气体的分压=气体的体积分数×体系的总压强,T℃时达到平衡,此时体系的总压强为p=30MPa,则T℃时该反应的压力平衡常数Kp =_______;平衡后,若保持温度不变,再向容器中充入NO和CO2各0.3mol,平衡将_____ (填“向左”、“向右”或“不”)移动。
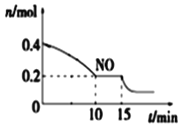
②15 min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的条件可能是_____(填序号)
A.升温 B.增大CO浓度 C.加入催化剂 D.减小容器体积
(3)在373K时,向体积为2L的恒容真空容器中通入0.40molNO2,发生反应:2NO2(g)![]() N2O4(g) ΔH=57.0kJ·mol1。测得NO2的体积分数[φ(NO2)]与反应时间(t)的关系如下表:
N2O4(g) ΔH=57.0kJ·mol1。测得NO2的体积分数[φ(NO2)]与反应时间(t)的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 |
φ(NO2) | 1.0 | 0.75 | 0.52 | 0.40 | 0.40 |
①0~20min内,v(N2O4)=_________________。
②上述反应中,v正(NO2)=k1·c2(NO2),v逆(N2O4)=k2·c(N2O4),其中k1、k2为速率常数,则373K时,k1、k2的数学关系式为__________。
(4)最新研究发现,用隔膜电解法可以处理高浓度乙醛废水。原理:使用惰性电极电解,乙醛分別在阴、阳极转化为乙醇和乙酸,总反应为2 CH3CHO+H2O![]() CH3CH2 OH+CH3COOH。实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置示意图如图所示
CH3CH2 OH+CH3COOH。实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置示意图如图所示
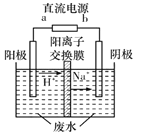
①电解过程中,两极除分别生成乙酸和乙醇外,均产生无色气体,阳极电极反应分別为4OH--4e-=O2↑+2H2O、__________________。
②在实际工艺处理过程中,阴极区乙醛的去除率可达60%。若在两极区分別注入1m3乙醛的含量为300mg/L的废水,可得到乙醇_______kg(计算结果保留2位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中,甲是电解饱和食盐水,乙是铜的电解精炼,丙是电镀,回答:
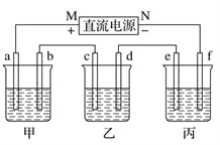
(1)b极上的电极反应式为__,甲电池的总反应化学方程式是__。
(2)在粗铜的电解过程中,图中c电极的材料是__(填“粗铜板”或“纯铜板”);在d电极上发生的电极反应为__;若粗铜中还含有Au、Ag、Fe等杂质,则沉积在电解槽底部(阳极泥)的杂质是__,电解一段时间后,电解液中的金属离子有__。
(3)如果要在铁制品上镀镍(二价金属,相对原子质量59),则f电极的材料是__(填“铁制品”或“镍块”,下同),e电极的材料是__。
(4)若e电极的质量变化118 g,则a电极上产生的气体在标准状况下的体积为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3,杂质为SiO2、Al2O3)为原料生产它,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如图。涉及的主要反应是:6FeO·Cr2O3+24NaOH+7KClO3=12Na2CrO4+3Fe2O3+7KCl+12H2O

(1)碱浸前将铬铁矿粉碎的作用是_______________。
(2)步骤③调节pH后过滤得到的滤渣是____________。
(3)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式________。
(4)用简要的文字说明操作⑤加入KC1的原因____________。
(5)称取重铬酸钾试样2.500g配成250mL溶液,取出25mL于碘量瓶中,加入10mL 2mol/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min。然后加入100mL水,加入3mL淀粉,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I一十S4O52-)
①滴定时淀粉的作用为_______,判断达到滴定终点的依据是_____________。
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品中重铬酸钾的纯度为(设整个过程中其它杂质不参加反应)_____________(保留2位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g)+2B(g)![]() xC(g)△H=﹣192kJmol﹣1,向M、N中都通入1mol A和2mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )
xC(g)△H=﹣192kJmol﹣1,向M、N中都通入1mol A和2mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )
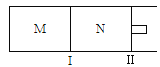
A. 若x=3,达到平衡后A的体积分数关系为:φ(M)>φ(N)
B. 若x>3,达到平衡后B的转化率关系为:α(M)>α(N)
C. 若x<3,C的平衡浓度关系为:c(M)>c(N)
D. x不论为何值,起始时向N容器中充入任意值的C,平衡后N容器中A的浓度均相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com