
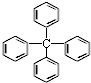
| A. | 该有机物分子式为C25H24 | |
| B. | 该多环芳烃属于稠环芳烃 | |
| C. | 该分子中最多可能有13个碳原子在同一平面上 | |
| D. | 该有机物能使酸性高锰酸钾溶液褪色 |
分析 A.根据有机物的结构简式判断分子式;
B.稠环芳烃必须是两个及两个以上苯环直接相连;
C.根据苯和甲烷的结构判断有机物的空间结构;
D.根据苯的化学性质可知,该有机物不能与酸性高锰酸钾反应.
解答 解:A.分子中含有4个苯环,共含有25个C和20个H,则分子式为C25H20,故A错误;
B.稠环芳烃必须是两个及两个以上苯环直接相连,该结构不属于稠环芳烃,故B错误;
C.分子中含有饱和烃基,具有甲烷的结构特点,四面体碳最多三原子共平面,与饱和碳原子相连的两个苯环与饱和碳原子可能在同一平面,故最多13个碳原子在同一平面上,故C正确;
D.根据苯的化学性质可知,该有机物不能与酸性高锰酸钾反应,溶液不褪色,故D错误;
故选C.
点评 本题考查有机物的结构和性质,为高考常见题型,侧重于考查学生的分析能力和综合运用化学知识的能力,注意把握有机物的空间结构,为解答该题的易错点.


科目:高中化学 来源: 题型:选择题
| A. | 硫酸 纯碱 硫酸钙 | |
| B. | 氢氯酸 烧碱 硫酸亚铁 | |
| C. | 碳酸 乙醇 烧碱 | |
| D. | 磷酸 熟石灰 苛性钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和苯都能使溴的四氯化碳褪色 | |
| B. | 石油分馏是物理变化,可得到汽油、煤油等物质 | |
| C. | 石油裂化主要得到乙烯 | |
| D. | 煤制煤气是物理变化,是高效、清洁地利用煤的重要途径 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀释后溶液的pH=9 | |
| B. | 稀释过程中,溶液中所有离子的浓度均减小 | |
| C. | 稀释后溶液中$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$ 减小 | |
| D. | 该氨水稀释前后中和盐酸的能力相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化氢的摩尔质量等于NA个氯化氢分子的质量 | |
| B. | 常温常压下1mol二氧化碳的体积大于22.4L | |
| C. | 64g金属铜发生氧化反应,一定失去2NA个电子 | |
| D. | 62g氧化钠溶于水后,所得溶液中含有NA个O2-离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上用电解熔融氯化镁制镁蒸汽 | |
| B. | 工业上用钠和熔融氯化钾反应制取钾(850℃) | |
| C. | 工业上用碳酸钠制取碳酸氢钠 | |
| D. | 工业上炼铁时,常用石灰石除去铁矿石中的SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解质溶液中有电离出的自由移动的离子 | |
| B. | 有导线将两个活泼性不同的电极连接 | |
| C. | 在不同金属的两极间存在电势差 | |
| D. | 在原电池中发生了氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现用乙烯和其它无机物为原料合成环状有机物E(C6H8O4)的流程如下:
现用乙烯和其它无机物为原料合成环状有机物E(C6H8O4)的流程如下: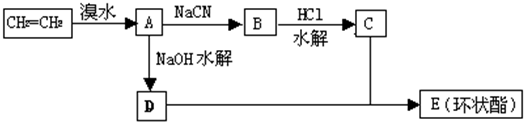
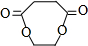 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
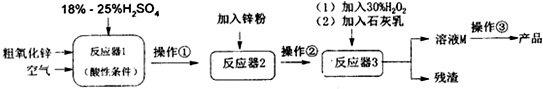
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com