
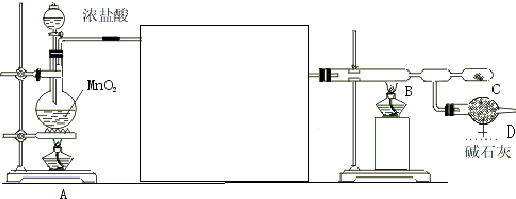
 某课外活动小组探索苯与液溴的反应是否属于取代反应,设计了如下实验装置.
某课外活动小组探索苯与液溴的反应是否属于取代反应,设计了如下实验装置.
分析 根据实验装置图可知,用溴和苯的混合液加入铁粉中,反应生成溴苯和溴化氢,由于溴和苯都易挥发,所以要用四氯化碳除去溴化氢中的溴蒸汽和苯,用硝酸银检验生成的溴化氢,进而确定该反应为取代反应,
(1)根据题意,装置 A 中是用溴和苯在铁粉作催化剂的作用下发生取代反应生成溴苯和溴化氢;
(2)若溴和苯发生取代反应应生成溴化氢,所以可以通过证明产物中有溴化氢,进而确定反应的类型;
(3)溴和苯都易挥发,挥发出的溴对产生的溴化氢的检验有干扰,所以要除去;
(4)反应后生成的溴苯的沸点较高,会留在试管中,溴苯的密度大于水,溴能被氢氧化钠溶液吸收而除去,据此判断.
解答 解:(1)根据题意,装置 A 中是用溴和苯在铁粉作催化剂的作用下发生取代反应生成溴苯和溴化氢,反应的方程式为 ,
,
故答案为: ;
;
(2)若溴和苯发生取代反应应生成溴化氢,所以会在C 中导管口有白雾产生,生成淡黄色沉淀,
故答案为:C 中导管口有白雾产生,生成淡黄色沉淀;
(3)溴和苯都易挥发,挥发出的溴对产生的溴化氢的检验有干扰,所以装置 B 的作用是吸收挥发出的溴单质,由于挥发出的溴单质也能与硝酸银溶液生成浅黄色沉淀,所以如果没有 B 装置不能判断是否有 HBr 生成,无法验证是否发生了取代反应,
故答案为:吸收挥发出的溴单质;不能判断是否有 HBr 生成,无法验证是否发生了取代反应;
(4)反应后生成的溴苯的沸点较高,会留在试管中,所以反应后有机产物在 A装置中,溴苯的密度大于水,有机产物在下层,由于溶有溴单质通常颜色为褐色,可用NaOH 溶液除去溴,
故答案为:A;下;NaOH.
点评 本题考查了溴苯的制取实验,掌握物质性质,了解物质除杂和检验的方法,理解取代反应的实质是解题的关键,题目难度中等.


科目:高中化学 来源: 题型:填空题
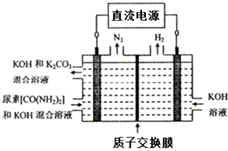 工业上常用CO2和NH3通过如下反应合成尿素[CO(NH2)2].
工业上常用CO2和NH3通过如下反应合成尿素[CO(NH2)2].| 时间/min | 0 | 20 | 70 | 80 | 100 |
| 万(CO2)/mol | 0.10 | 0.060 | 0.020 | 0.020 | 0.020 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 阿司匹林(乙酰水杨酸,)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下:
阿司匹林(乙酰水杨酸,)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下:
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 易水解 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
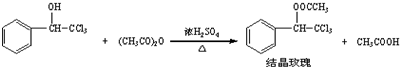
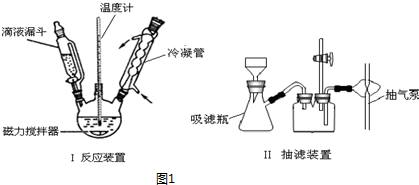
| 三氯甲基苯基甲醇 | 无色液体.不溶于水,溶于乙醇. |
| 醋酸酐 | 无色液体.溶于水形成乙酸,溶于乙醇. |
| 结晶玫瑰 | 白色至微黄色晶体.不溶于水,溶于乙醇.熔点:88℃ |
| 醋酸 | 无色的吸湿性液体,易溶于水、乙醇. |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com