
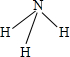
 ,它的共价键属于极性(填“极性”或“非极性”)键;含有离子键和非极性共价键的化合物的电子式为
,它的共价键属于极性(填“极性”或“非极性”)键;含有离子键和非极性共价键的化合物的电子式为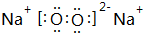 .
.分析 X、Y、Z、W四中元素是短周期元素,且原子序数依次增大,Z原子最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,则Z为O元素;Y、Z为同周期的相邻元素,则Y为N元素;W原子的质子数等于Y、Z原子的最外层电子数之和,则W原子质子数为5+6=11,故W为Na;X、W同主族,即处于IA族,而Y和X形成的分子中有3个共价键,则X为H元素.
解答 解:X、Y、Z、W四中元素是短周期元素,且原子序数依次增大,Z原子最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,则Z为O元素;Y、Z为同周期的相邻元素,则Y为N元素;W原子的质子数等于Y、Z原子的最外层电子数之和,则W原子质子数为5+6=11,故W为Na;X、W同主族,即处于IA族,而Y和X形成的分子中有3个共价键,则X为H元素.
(1)由上述分析可知,X、Z两种元素的元素符号分别为:H、O,
故答案为:H;O;
(2)由以上元素两两形成的化合物中,溶于水显碱性的气态氢化物为NH3,结构式为 ,它的共价键属于极性键,含有离子键和非极性共价键的化合物为Na2O2,电子式为
,它的共价键属于极性键,含有离子键和非极性共价键的化合物为Na2O2,电子式为 ,
,
故答案为: ;极性;
;极性; ;
;
(3)由H、N、O所形成的常见离子化合物是NH4NO3,
故答案为:NH4NO3.
点评 本题考查结构性质位置关系,推断元素是解题关键,侧重对化学用语与元素化合物性质的考查,有利于基础知识的巩固.


科目:高中化学 来源: 题型:选择题
| A. | 安全气囊中原料的配比为$\frac{n(Na{N}_{3})}{n(KN{O}_{3})}$=5 | |
| B. | 若在标准状况下,产生44.8L N2,则有0.25mol KNO3参与反应 | |
| C. | 上述复分解反应发生速度很快,瞬间能产生大量气体 | |
| D. | 根据安全气囊打开时产生气体的体积(标准状况),可大致计算出气囊中原料的质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
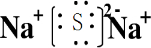 ,GSO3;
,GSO3;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在共价化合物中一定含有共价键 | |
| B. | 由非金属元素组成的化合物一定是共价化合物 | |
| C. | 含有离子键的化合物一定是离子化合物 | |
| D. | 双原子单质分子中的共价键一定是非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2、K2O2、C2H2 | B. | CaC12、BaO2、MgF2 | ||
| C. | CO2、CS2、KO2 | D. | NH4Cl、NaOH、KHS04 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
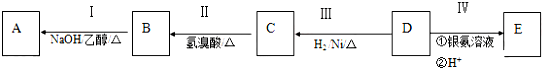
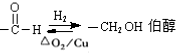

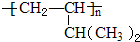
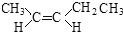
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②③⑤ | C. | ①②④ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
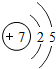 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它的名称是2,2-二甲基丁烷 | |
| B. | 它的核磁共振氢谱有3个峰 | |
| C. | 它的分子式为C6H14 | |
| D. | 若它由烯烃与H2加成而来,则烯烃有两种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com