
| A. | HN3水溶液中微粒浓度大小顺序为:c(HN3)>c(N${\;}_{3}^{-}$)>c(H+)>c(OH-) | |
| B. | HN3与NH3作用生成的叠氮酸铵是离子化合物 | |
| C. | NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N${\;}_{3}^{-}$)>c(OH-)>c(H+) | |
| D. | N${\;}_{3}^{-}$与CO2含相等电子数 |
分析 叠氮酸(HN3)与醋酸酸性相似,应为弱酸,
A.HN3水溶液呈弱酸性,根据电离特征比较离子浓度大小;
B.HN3与NH3作用生成的叠氮酸铵是离子化合物;
C.NaN3水溶液呈碱性,N3-水解;
D.根据原子的构成判断.
解答 解:A.HN3为弱酸,不能完全电离,电离程度较小,则有c(HN3)>c(H+),溶液呈酸性,则有c(H+)>c(OH-),溶液中还存在水的电离,则有c(H+)>c(N3-),所以有c(HN3)>c(H+)>c(N3-)>c(OH-),故A错误;
B.叠氮酸(HN3)与醋酸酸性相似,醋酸钠溶液呈碱性,则NaN3水溶液呈碱性,存在c(Na+)>c(N3-)>c(OH-)>c(H+),故B正确;
C.HN3与NH3作用生成的叠氮酸铵属于盐,为离子化合物,故C正确;
D.N3-含有电子数为3×7+1=22,CO2含有电子数为6+2×8=22,二者含相等电子数,故D正确.
故选A.
点评 本题考查离子浓度的大小比较,题目难度中等,注意把握题给信息,此为解答该题的关键,易错点为A,注意不能忽视水的电离.


科目:高中化学 来源: 题型:多选题
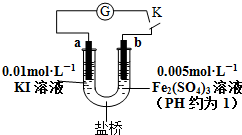
| A. | 电流计G指针指向零时,说明U形管中反应达到平衡状态 | |
| B. | 当电路中电流为零时,增加KI溶液的浓度,则a极为正极 | |
| C. | 当U形管b端颜色逐渐加深时,说明b极为负极 | |
| D. | 盐桥中阳离子一定向右移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 $?_{高温}^{FeSO_{4}/Al_{2}O_{3}}$
$?_{高温}^{FeSO_{4}/Al_{2}O_{3}}$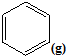 +3H2(g)
+3H2(g)查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
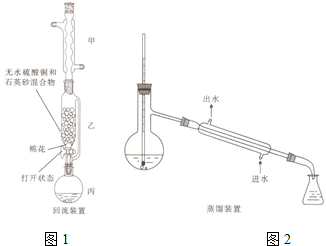 苯甲酸(
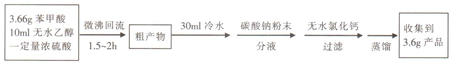
苯甲酸(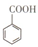 )和乙醇在浓硫酸催化下可以制得苯甲酸乙酯,及时除去反应中产生的水可提高酯的产率.据此某实验小组设计了如下图的装置来进行上述实验.相关信息如下:
)和乙醇在浓硫酸催化下可以制得苯甲酸乙酯,及时除去反应中产生的水可提高酯的产率.据此某实验小组设计了如下图的装置来进行上述实验.相关信息如下:| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解度 | |
| 苯甲酸 | 122 | 1.27 | 249 | 微溶 |
| 乙醇 | 46 | 0.789 | 78.3 | 易溶 |
| 苯甲酸乙酯 | 150 | 1.05 | 212.6 | 难溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
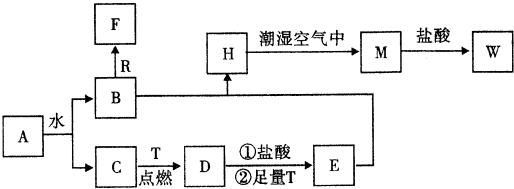
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl- | |
| B. | 与Fe反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42- | |
| C. | $\frac{{K}_{W}}{c({H}^{+})}$=1×10-13mol•L-1的溶液中:NH4+、Ca2+、Cl-、NO3- | |
| D. | 水电离的c(H+)=1×10-13mol•L-1的溶液中:K+、Na+、AlO2-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有-OH的有机化合物性质相同 | |
| B. | 锅炉水垢中的CaSO4可用饱和Na2CO3溶液处理,使之转化为CaCO3后再用盐酸除去 | |
| C. | 钠的金属性比钾强,工业上用钠制取钾(Na+KCl$\frac{\underline{\;850℃\;}}{\;}$K↑+NaCl) | |
| D. | 既有单质参加,又有单质生成的反应一定是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁燃烧发出耀眼的白光,可用来制造信号弹和焰火 | |
| B. | 碳酸氢钠能与酸反应,可用来治疗胃酸过多 | |
| C. | 利用铜与氯化铁溶液的反应来制作印刷电路板 | |
| D. | 铝制品表面有致密的氧化膜保护层,可长时间盛放咸菜等腌制食品 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com