
【题目】一定温度下,将0.1molAgCl固体加入1L 0.1mol·L-1Na2CO3溶液中,充分搅拌(不考虑液体体积变化),已知:Ksp(AgCl)=2×10-10;Ksp(Ag2CO3)=1×10-11,下列有关说法正确的是 ( )
A.沉淀转化反应2AgCl(s)+ CO32-(aq)![]() Ag2CO3(s)+2Cl-(aq)的平衡常数为20mol·L-1
Ag2CO3(s)+2Cl-(aq)的平衡常数为20mol·L-1
B.约有2×10-5mol AgCl溶解
C.反应后溶液中的:c(Na+)>c (CO32-) >c (Ag+)>c (Cl-) >c (H+)
D.反应后溶液中的:c(Na+)+ c (Ag+)+ c (H+)="c" (CO32-)+ c (HCO3-)+ c (Cl-) +c (OH-)
【答案】B
【解析】
A、Ksp(Ag2CO3)=c(Ag+)2×0.1=1×10-11,c(Ag+)=10-5,Ksp(AgCl)=c(Cl-)×10-5=2×10-10,c(Cl-)=2×10-5mol/L,K=c2(Cl)/ c(CO32) =(2×105)2/ 0.1=4×10-9,A错误;
B、c(Cl-)=2×10-5mol/L,在1L的溶液中,约有2×10-5mol AgCl溶解,B正确;
C、c(Na+)=0.2mol/L,c(Cl-)=2×10-5mol/L,c(CO32-)=0.1mol/L,c(Ag+)=10-5,所以c(Na+)>c(CO32-)>c(Cl-)>c(Ag+)>c(H+),C错误;
D、据电荷守恒,c(Na+)+ c(Ag+)+ c H+)=2c (CO32-)+ c(HCO3-)+ c (Cl-) +c (OH-),D错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】常温下,向20mL某一元酸(HA)溶液中逐滴加入0.1mol·L-1的NaOH溶液,测得混合溶液中由水电离出的c(H+)随加入NaOH溶液的体积变化关系图如下。下列说法不正确的是

A. Ka(HA)的数量级为10-5
B. d点溶液的pH最大
C. b点溶液显酸性,c(A-)>c(Na+)>c(H+)>c(OH-)
D. d点溶液中,c(Na+)+c(H+)=c(A-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水中存在如下平衡:H2O+H2O![]() H3O++OH- ΔH>0,现欲使平衡向右移动,且所得溶液呈酸性,选择的方法是( )
H3O++OH- ΔH>0,现欲使平衡向右移动,且所得溶液呈酸性,选择的方法是( )
A.加热水至100℃[其中c(H+)=1×10-6mol·L-1]B.向水中加入NaHSO4
C.向水中加入Cu(NO3)2D.在水中加入Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化)。下列各组物质中,满足图示转化关系的是( )

物质 选项 | 甲 | 乙 | 丙 | 戊 | 丁 |
A | Cu | HNO3 | Cu(NO3)2 | Fe | NO |
B | H2O | Fe | H2 | O2 | Fe2O3 |
C | Al | NaOH | H2 | Al2O3 | NaAlO2 |
D | CH3CHO | O2 | CH3COOH | H2 | H2O |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在晶体中,微观粒子是有规律排布的。而实际上的晶体与理想结构或多或少会产生偏离,这种偏离称为晶体的缺陷。由于晶体缺陷,氧化铁FexO中的x常常不确定。
(1)请写出铁原子基态电子排布式___________________。
(2)Fe2+与Fe3+相比,较稳定的是___________,请从二者结构上加以解释_______________。
(3)硫氰根离子和异硫氰根离子都可用SCN-表示,碳原子都处于中央,则碳原子的轨道杂化类型为____________________。其中异硫氰根离子与CO2是等电子体,异硫氰根离子的电子式为________________。Fe3+与SCN-可以形成配位数![]() 的配离子,若Fe3+与SCN-以个数比1:5配合,则FeCl3与KSCN在水溶液中发生反应的化学方程式可以表示为_____________。
的配离子,若Fe3+与SCN-以个数比1:5配合,则FeCl3与KSCN在水溶液中发生反应的化学方程式可以表示为_____________。
(4)如图:铁有![]() 、
、![]() 、
、![]() 三种同素异形体,三种晶体在不同温度下能发生转化。
三种同素异形体,三种晶体在不同温度下能发生转化。
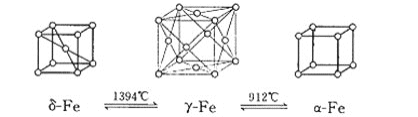
请问:![]() 、
、![]() 、
、![]() 这三种晶胞的棱长之比为:___________。
这三种晶胞的棱长之比为:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G是短周期主族元素,原子序数依次增大,部分元素的部分信息如下表所示:
A | B | C | D | E | F | |
原子半径/nm | 0.077 | 0.075 | 0.074 | 0.099 | ||
主要 化合价 | +4 -4 | +5 -3 | -2 | +6 -2 | ||
其他 | 一种同位素原子无中子 | 所有有机物中一定含有的元素 | 简单氢化物常用作制冷剂 | 短周期主族元素中原子半径最大 |
回答下列问题(用相应化学用语):
(1)G在周期表中的位置是___,F的简单离子结构示意图是___。
(2)由A、C、G三种元素形成的原子个数比为4:1:1的化合物的电子式为___,该化合物所含的化学键有___。(填化学键类型)
(3)D、E、F、G简单离子半径由小到大顺序___。
(4)用电子式表示BD2的形成过程___。
(5)C、D、F的简单氢化物中沸点由高到低的顺序是___。
(6)写出E2D2和A2D反应的化学方程式___,该反应每消耗1molE2D2电子转移数目为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学-选修3:物质结构与性质]固体电解质有广泛的用途。研究发现,晶体中有特殊结构为离子(如Li+)提供快速迁移的通道或者有“点缺陷”。都能使其具有导电潜力,比如:图(a)所示的锂超离子导体Li3SBF4和图(b)所示的有“点缺陷”的NaCl。
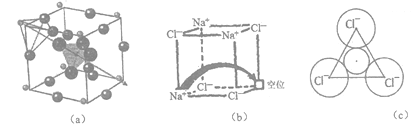
根据所学知识回答下列问题:
(1)在变化“Cl+e-→Cl-”过程中,所得电子填充在基态 Cl的________能级,此过程会________ (填“吸收”或“释放”)能量。
(2)BF4-中B的杂化形式为________________,其等电子体为___________(任写一种)。与其VSEPR模型相同,且有l对孤电子对的相对分子质量最小的分子是___________。
(3)图(a)所示晶胞中Li+位于_____位置;若将晶体中BF4-换成F-,导电能力会明显降低,原因是______________________________。
(4)图(6)中,若缺陷处填充了Na+,则它__________(填“是”或“不是”) NaCl的晶胞,在NaCl晶体中,Na+填充在Cl-堆积而成的__________面体空隙中。
(5)有人认为:高温下有“点缺陷”的NaCl晶伙导电性增照是由于Na+迁移到另一空位而造成。其中Na+经过一个由3个Cl-组成的最小三角形窗孔(如图c所示)。已知晶胞参数a=564 pm,r(Na+)=116pm, r(Cl-)=167 pm,通过计算三角形窗孔半径,判断该认识是否正确。__________。(已知:![]() ≈1.414,
≈1.414,![]() ≈1.732)
≈1.732)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组数据中,前者刚好是后者两倍的是( )
A.2mol水的摩尔质量和1mol水的摩尔质量
B.200mL1mol/L氯化钙溶液中c(Cl-)和100mL2mol/L氯化钾溶液中c(Cl-)
C.32g二氧化硫中氧原子数和标准状况下11.2L一氧化碳中氧原子数
D.20%NaOH溶液中NaOH的物质的量浓度和10%NaOH溶液中NaOH的物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铁铵[NH4Fe(SO4)2·xH2O]是一种重要铁盐。为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁铵,具体流程如下:

回答下列问题:
(1)步骤①的目的是去除废铁屑表面的油污,方法是_________________。
(2)步骤②需要加热的目的是_________________,温度保持80~95 ℃,采用的合适加热方式是_________________。铁屑中含有少量硫化物,反应产生的气体需要净化处理,合适的装置为_________________(填标号)。

(3)步骤③中选用足量的H2O2,理由是_________________。分批加入H2O2,同时为了_________________,溶液要保持pH小于0.5。
(4)步骤⑤的具体实验操作有______________,经干燥得到硫酸铁铵晶体样品。
(5)采用热重分析法测定硫酸铁铵晶体样品所含结晶水数,将样品加热到150 ℃时,失掉1.5个结晶水,失重5.6%。硫酸铁铵晶体的化学式为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com