
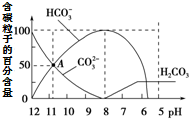
 常温下在20mL 0.1mol•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1 HCl溶液40mL,溶液中含碳粒子的百分含量随pH的变化如图所示.下列说法不正确的是( )
常温下在20mL 0.1mol•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1 HCl溶液40mL,溶液中含碳粒子的百分含量随pH的变化如图所示.下列说法不正确的是( )| A. | 0.1 mol•L-1 Na2CO3溶液中:c(OH-)=2c(H2CO3)+c(HCO3-)+c(H+) | |
| B. | A点:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| C. | 0.05 mol•L-1 NaHCO3溶液的pH=8 | |
| D. | pH=7时混合液中c(Na+)=2c(CO32-)+c(HCO3-)+c(Cl-) |
分析 A.0.1 mol•L-1 Na2CO3溶液中存在质子守恒,氢离子总浓度和氢氧根离子总浓度相同;
B.A点时:c(CO32-)和c(HCO3-)相同,溶液显碱性;
C.c(HCO3-)=100%时,溶液的pH=8,溶液显碱性,碳酸氢根离子水解程度大于其电离程度;
D.溶液中电荷守恒分析判断.
解答 解:A.0.1 mol•L-1 Na2CO3溶液中存在质子守恒,氢离子总浓度和氢氧根离子总浓度相同,c(OH-)=2c(H2CO3)+c(HCO3-)+c(H+),故A正确;
B.由图象可知,A点时:c(CO32-)和c(HCO3-)相同,溶液显碱性,则c(Na+)>c(CO32-)═c(HCO3-)>c(OH-)>c(H+),故B错误;
C.0.05 mol•L-1 NaHCO3溶液碳中酸氢根离子水解程度大于其电离程度,c(HCO3-)=100%时,溶液的pH=8,说明0.05mol/L NaHCO3溶液的pH=8,故C正确;
D.在20mL 0.1mol•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1 HCl溶液40mL,溶液中在电荷守恒为c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)+c(Cl-),pH=7时混合液中c(Na+)=2c(CO32-)+c(HCO3-)+c(Cl-),故D正确;
故选B.
点评 本题考查溶液离子浓度大小比较、离子反应、溶液中守恒关系的应用等问题,题目难度中等,注意分析图象曲线变化趋势,把握物质的性质.


科目:高中化学 来源: 题型:多选题
| A. |  的分子式为C17H24O3 的分子式为C17H24O3 | |
| B. | 结构为…-CH=CH-CH=CH-CH=CH-CH=CH-…的高分子化合物,其单体是乙炔 | |
| C. | 在碱性条件下,CH3CO18OC2H5的水解产物是CH3COOH和C2H518OH | |
| D. | 完全燃烧等质量的甲醛、乙酸、葡糖糖、蔗糖消耗的氧气量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
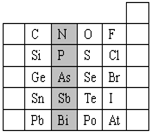 元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA | |
| B. | 3.4 g NH3中含N-H键数目为0.2NA | |
| C. | 电解精炼铜的过程中,粗铜与电源的负极相连 | |
| D. | CaC2阴阳离子的数目比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数相差8的两种短周期元素,其周期序数必相差1 | |
| B. | 氢化锂三兄弟-LiH、LiD、LiT三种物质的质子数之比为4:5:6 | |
| C. | 除零族元素外,短周期元素的最高正价在数值上都等于该元素所属的族序数 | |
| D. | 第三周期非金属元素含氧酸的酸性从左到右依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 溶液 | A | B | C | D |
| 加入盐酸后的现象 | 无明显变化 | 无明显变化 | 有气泡产生 | 无明显变化 |
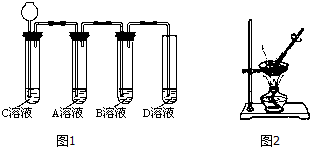
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:
如图是以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:| ①Zn为正极,Cu为负极; ②H+向负极移动; ③Cu极有H2产生; ④电子流动方向Zn→G→Cu; ⑤正极的电极反应式是Zn-2e-=Zn2+: ⑥若有1mol电子流过导线,则理论上产生0.5mol H2. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com