
【题目】下列反应(均未配平)中,氧化剂与还原剂物质的量的关系为1∶2的是
A.Cu+H2SO4![]() CuSO4+SO2↑+H2O
CuSO4+SO2↑+H2O
B.CH3COOH+Ca(ClO)2![]() HClO+Ca(CH3COO)2
HClO+Ca(CH3COO)2
C.I2+NaClO3![]() NaIO3+Cl2
NaIO3+Cl2
D.HCl+MnO2![]() MnCl2+Cl2↑+H2O
MnCl2+Cl2↑+H2O
【答案】D
【解析】
据化合价变化判断氧化还原反应,分析氧化剂、还原剂。又据化合价升降总数相等,求氧化剂、还原剂的物质的量之比。
A. Cu元素化合价升高2,Cu是还原剂。S元素化合价降低2,H2SO4是氧化剂。氧化剂、还原剂的物质的量之比为1:1,A项错误;
B. CH3COOH与Ca(ClO)2发生复分解反应,不属于氧化还原反应,B项错误;
C. 碘元素化合价升高5,I2是还原剂。氯元素化合价降低,NaClO3是氧化剂。NaClO3与I2物质的量之比为2:1,C项错误;
D. 氯元素化合价升高1,HCl是还原剂。锰元素化合价降低2,MnO2是氧化剂。氧化剂、还原剂的物质的量之比为1:2,D项正确。
本题选D。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】LiMn2O4是一种无污染、成本低的锂离子电池电极材料,某研究小组利用柠檬酸配合法制备LiMn2O4。
(1)按一定配比将醋酸锂(CH3COOLi)和醋酸锰[(CH3COO)2Mn]溶液混合后,加入柠檬酸(分子式C6H8O7)溶液中配成混料。用6 mol·L-1氨水调节pH至6.5~9,在75℃~85℃水浴中加热,制得柠檬酸配合物(其中Mn为+2价)。装置如图所示(加热和夹持装置已略去)。
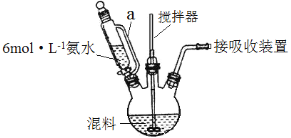
①滴液漏斗中a管的作用是________。
②实验室用14.8 mol·L-1浓氨水配制250 mL 6mol·L-1的氨水需要的仪器有胶头滴管、烧杯、玻璃棒、量筒、________。
③调节pH至6.5~9是为了促进柠檬酸电离。pH不能大于9的原因是______。
④用水浴加热的目的是__________。
(2)将制得的配合物在烘箱中真空干燥得到固态柠檬酸配合物前驱体,研磨后焙烧,得LiMn2O4。
①柠檬酸配合物前驱体应放在_______(填仪器名称)中焙烧。
②焙烧需要在空气中进行的原因是__________。
③焙烧产生的气体是________。
(3)测定产品中锰的含量:准确称取0.1000 g的产品试样,加入足量浓盐酸溶液加热溶解,驱赶溶液中残留的Cl2,配成250 mL溶液。取25.00 mL溶液于锥形瓶中用0.02000 mol·L-1EDTA(Mn2+与EDTA按1:1络合)滴定,消耗EDTA溶液的体积V mL。样品中锰的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香酯类化合物A、B互为同分异构体,均含C、H、O三种元素。相同状况下,A、B蒸气对氢气的相对密度是97,分子中C、H原子个数相同,且C、H原子个数之和是氧原子数的5倍。已知:各有机物间存在如下转化关系:
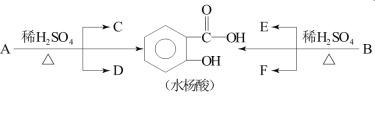
其中C能发生银镜反应,F经连续氧化可生成C;C与D是相对分子质量相同的不同类有机物。
(1)A的分子式是________。
(2)E中所含官能团的名称是________;完全燃烧时,1 mol D与1 mol下列________的耗氧量相同(填字母代号)。
a.C3H6O3 b.C3H8O c.C2H4 d.C2H6O2
(3)写出水杨酸与小苏打反应的化学方程式是___________;写出C与F反应的化学方程式是_________。
(4)同时符合下列要求的同分异构体有___________种。
①与A互为同分异构体;
②能发生水解反应;
③苯环上有两个取代基,且苯环上的一氯代物只有1种。
(5)1 mol 上述(4)中的一种有机物X,能与4 mol NaOH发生反应,写出此反应的化学方程式__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】邻硝基甲苯和对硝基甲苯能被用作爆炸品检测的示踪剂。某探究小组利用下图反应和装置制备一硝基甲苯。
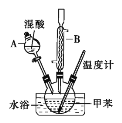
实验中可能用到的数据:
密度/g·cm-3 | 沸点/℃ | 溶解性 | |
甲苯 | 0.866 | 110.6 | 不溶于水,易溶于硝基甲苯 |
对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液态烃 |
实验步骤:
①按体积比1∶3配制浓硫酸与浓硝酸的混合物80mL;②在250mL的三颈烧瓶中加入30mL(26g)甲苯,按图所示装好药品和其他仪器;③向三颈烧瓶中加入混酸,并不断搅拌(磁力搅拌器已略去);④控制温度约为50℃,反应大约10min,三颈烧瓶底有大量淡黄色油状液体出现;⑤分离出一硝基甲苯的总质量为27.20g。
请回答下列问题:
(1)使用仪器A前必须进行的操作是_______。
(2)该实验采用水浴加热,水浴加热的优点有:受热均匀、_______。
(3)配制混酸的方法是分别量取20mL浓硫酸和60mL浓硝酸,将浓_______倒入烧杯中,浓_______沿着烧杯内壁缓缓注入,并不断搅拌。
(4)控制温度约为50℃时,反应生成的产物一硝基甲苯是邻硝基甲苯和对硝基甲苯混合物,写出该反应生成对硝基甲苯的化学方程式_______。
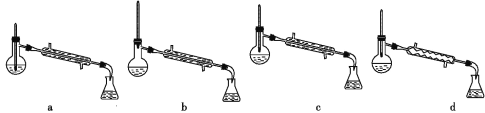
(5)分离反应后产物的方案如下:

①操作1的名称为_______。
②操作2中,下列仪器选择及安装正确的是_______(填字母)。
(6)该实验中一硝基甲苯的产率为_______(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,根据图示回答:
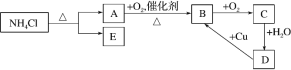
(1)A 的分子式为_____;B 的分子式为_____;C 的分子式为_____。
(2)将 E 溶于水,配制成 0.1 mol·L-1的溶液,滴入酚酞,显_____色。
(3)写出NH4Cl 溶液与NaOH 溶液共热反应的离子方程式:__________________。
(4)D→B 的化学方程式为:_____。
(5)A→B 的化学反应方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.已知25℃,NH3·H2O的Kb=1.8×105,H2SO3的Ka1=1.3×102,Ka2=6.2×108。若氨水的浓度为2.0 mol·L1,溶液中的c(OH)=_______mol·L1,0.1 mol·L1的(NH4)2SO3溶液显______(填“酸性”、“碱性”或“中性”)。
Ⅱ. 某学生用0.200mol/L的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管,并注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下读数
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
请回答:
(1)以上步骤有错误的是______ (填编号)。
(2)滴定终点的现象为____________________________________________。
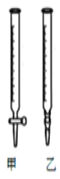
(3)用标准NaOH溶液滴定时,应将标准NaOH溶液注入______ 中(从图中选填“甲”或“乙”)。
(4)下列操作会引起实验结果偏大的是______![]() 填编号
填编号![]() 。
。
A.在锥形瓶装液前,留有少量蒸馏水
B.滴定前,滴定管尖嘴有气泡,滴定后无气泡
C.滴定终点俯视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.(CH3)3CCH2(CH3)C=CH2的名称为:2,2,4-三甲基-4-戊烯
B.![]() 在一定条件下可以发生缩聚反应生成高分子化合物
在一定条件下可以发生缩聚反应生成高分子化合物
C.1mol 有机物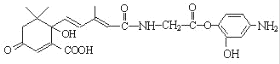 与 NaOH 溶液反应,最多消耗 6molNaOH
与 NaOH 溶液反应,最多消耗 6molNaOH
D.用氢氧化钠溶液可以除去乙酸乙酯中混有的乙酸、乙醇杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人工光合系统装置(如图)可实现以CO2和 H2O 合成CH4。下列有关说法不正确的是( )
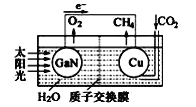
A.该装置中GaN为负极
B.电池工作时H+向Cu电极移动
C.Cu电极的电极反为: CO2+8e-+8H+═CH4+2H2O
D.该装置中涉及的能量转化形式只有两种
查看答案和解析>>
科目:高中化学 来源: 题型:
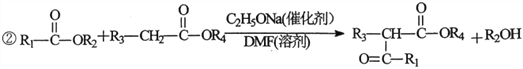
【题目】2一氧代环戊羧酸乙酯(K)是常见医药中间体,聚酯G是常见高分子材料,它们的合成路线如下图所示:
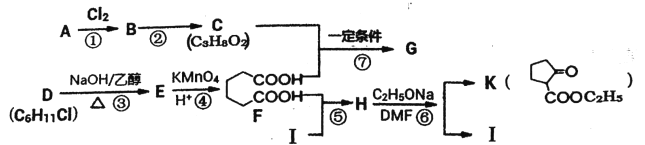
已知:①气态链烃A在标准状况下的密度为1.875g·L-1;
(1)B的名称为__________;E的结构简式为__________。
(2)下列有关K的说法正确的是__________。
A.易溶于水,难溶于CCl4
B.分子中五元环上碳原子均处于同一平面
C.能发生水解反应加成反应
D.1molK完全燃烧消耗9.5molO2
(3)⑥的反应类型为__________;⑦的化学方程式为__________
(4)与F官能团的种类和数目完全相同的同分异构体有__________种(不含立体结构),其中核磁共振氢谱为4组峰,且峰面积之比为1:2:3:4的是__________(写结构简式)。
(5)利用以上合成路线中的相关信息,请写出以乙醇为原料(其他无机试剂任选)制备![]()
的合成路线:__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com