
| A. | 工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率 | |
| B. | 合成氨工业中使用催化剂,以提高NH3的产量 | |
| C. | 红棕色的NO2加压后颜色先变深再变浅 | |
| D. | CO2(g)?CO2(aq)△H<0,降温增压可增大二氧化碳气体在水中的溶解度 |
分析 勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动,使用勒夏特列原理时,该反应必须是可逆反应,否则勒夏特列原理不适用.
解答 解:A.SO2催化氧化成SO3的反应,加入过量的空气,平衡正向移动,所以增加氧气的量能增大二氧化硫的转化率,能用勒夏特列原理解释,故A不选;
B.催化剂只能改变反应速率不影响平衡移动,所以不能用平衡移动原理解释,故B选;
C.可以可逆反应2NO2(g)?N2O4(g),正反应为体积缩小的反应,加压后二氧化氮的浓度增大,所以气体有色加深,由于增大了压强,平衡向生成四氧化二氮的方向移动,故加压后颜色先变深后变浅,可以平衡移动原理解释,故C不选;
D.该反应的正反应是气体体积减小的放热反应,增大压强、降低温度平衡都向正反应方向移动,所以降温增压可增大二氧化碳气体在水中的溶解度,可以用平衡移动原理解释,故D不选;
故选B.
点评 本题考查化学平衡移动原理,为高频考点,化学平衡移动原理只适用于改变条件能引起平衡移动的可逆反应,为易错题.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 弱酸 | H2CO3 | H2SO3 | HClO |
| 电离平衡常数 (25℃) | Ki1=4.30×10-7 Ki2=5.61×10-11 | Ki1=1.54×10-2 Ki2=1.02×10-7 | Ki=2.95×10-8 |
| A. | NaHSO3溶液中的离子浓度大小为:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-) | |
| B. | 相同温度时三种溶液的pH关系:Na2CO3>NaClO>Na2SO3 | |
| C. | ClO-+CO2+H2O=HClO+HCO3- | |
| D. | 2ClO-+SO2+H2O=2HClO+SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | ④ |
| 0.1mol/L NaOH溶液 | pH=11 NaOH溶液 | 0.1mol/L CH3COOH溶液 | pH=3 CH3COOH溶液 |
| A. | 由水电离出H+的浓度c(H+):①>③ | |
| B. | 将④加蒸馏水稀释至原来的100倍时,所得溶液的pH=5 | |
| C. | ①与③等体积混合后溶液PH为a,②与④等体积混合后溶液PH为b.则a>b | |
| D. | 1ml③和100ml④分别与足量金属镁反应,产生的H2一样多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 流出溶液的体积为(m-n) mL | B. | 流出溶液的体积为(n-m) mL | ||
| C. | 管内溶液体积等于(a-n) mL | D. | 管内溶液体积多于n mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
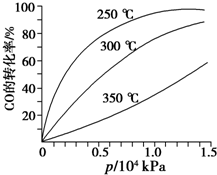 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 得电子越多,其氧化性越强 | |
| B. | 阳离子只有氧化性,阴离子只有还原性 | |
| C. | 要完成SO32-→SO42-的转化,必须加入氧化剂 | |
| D. | 金属活动顺序表中,排在前面的金属阳离子的氧化性强于排在后面的金属阳离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若甲烧杯中溶液浓度为0.1 mol•L-1,则乙烧杯中溶液浓度大于0.01 mol•L-1 | |
| B. | 向甲烧杯中加入等体积pH=(14-a)的NaOH溶液后,溶液显碱性 | |
| C. | 两溶液中水电离出的OH-浓度:10C甲(OH-)<C乙(OH-) | |
| D. | 取等体积甲乙溶液分别与适量NaOH溶液完全中和,所得溶液的pH:甲>乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com