
硫酸铜在工农业生产和生活中都有重要的应用。请回答下列问题:
(1)铜与浓硫酸共热是制备硫酸铜的方法之一,写出反应的化学方程式:__________________。但该反应生成的气体污染环境。为避免环境污染,可在铜粉与稀硫酸的混合物中通入热空气,反应的总化学方程式为____________________。
(2)将铜粉置于稀硫酸中不发生反应,加入双氧水,则铜粉可逐渐溶解。写出反应的离子方程式:____________________。
(3)将适量稀硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶可得到硫酸铜晶体。为了节约原料,H2SO4和HNO3的物质的量之比最佳为________________。
(4)用惰性电极电解硫酸铜溶液,实验装置如图甲所示。图乙是电解过程中产生气体的总体积V与转移电子的物质的量n(e-)的关系图。
电解过程中,a电极的现象是______________;b电极的电极反应式为____________________。
 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:填空题
下图表示的是向Na2CO3溶液中滴入稀盐酸时产生CO2
的过程。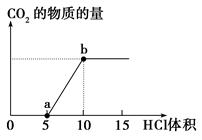
(1)写出a点以前发生反应的离子方程式:_____________________________________
(2)写出a到b点发生反应的离子方程式:_____________________________________
(3)若某Na2CO3溶液中含m mol Na2CO3,向其中滴入一定量的稀盐酸,恰好使溶液中Cl-和HCO的物质的量浓度之比为2∶1,则滴入的稀盐酸中的HCl的物质的量等于________mol(用含字母m的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铜及其化合物在生产、生活中有广泛的应用。
(1)铜可采用如下方法制备:
火法炼铜:Cu2S+O2 2Cu+SO2
2Cu+SO2
湿法炼铜:CuSO4+Fe=FeSO4+Cu
上述两种方法中,铜元素均被________(填“氧化”或“还原”)成铜单质。
(2)印刷电路板上使用的铜需要回收利用。
方法一:用FeCl3溶液浸泡印刷电路板制备CuCl2·2H2O,实验室模拟回收过程如下: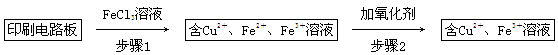

①证明步骤1所加FeCl3溶液过量的方法是_________________________________。
②步骤2中所加的氧化剂最适宜的是______________________________________。
A.HNO3 B.H2O2 C.KMnO4
③步骤3的目的是使溶液的pH升高到4.2,此时Fe3+完全沉淀,可选用的“试剂1”是________。(写出一种即可)
④蒸发浓缩CuCl2溶液时,要滴加浓盐酸,目的是________(用化学方程式并结合简要的文字说明),再经冷却、结晶、过滤,得到CuCl2·2H2O。
方法二:用H2O2和稀硫酸共同浸泡印刷电路板制备硫酸铜时,其热化学方程式是:
Cu(s)+H2O2(l)+H2SO4(aq)=CuSO4(aq)+2H2O(l) ΔH1=-320 kJ·mol-1
又知:2H2O2(l)=2H2O(l)+O2(g)ΔH2=-196 kJ·mol-1
H2(g)+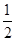 O2(g)=H2O(l) ΔH3=-286 kJ·mol-1
O2(g)=H2O(l) ΔH3=-286 kJ·mol-1
则反应Cu(s)+H2SO4(aq)=CuSO4(aq)+H2(g)的ΔH=________。
(3)欲实现反应Cu+H2SO4=CuSO4+H2↑,在你认为能实现该转化的装置中的括号内,标出电极材料(填“Cu”或“C”)。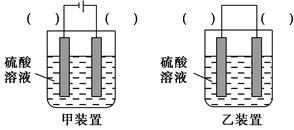
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
我国濒临海域的省份,能够充分利用海水制得多种化工产品。下图是以海水、贝壳(主要成分CaCO3)等为原料制取几种化工产品的工艺流程图,其中E是一种化肥,N是一种常见的金属单质。
结合上述工艺流程回答下列问题:
(1)物质G和L的化学式分别为 和 ;固体B是生活中的一种必需品,主要用作
(2)上述工艺流程中可以循环使用的物质的化学式为
(3)反应①的化学方程式为 ;在反应①中必须先通入NH3,而后通入D,其原因是
(4)工业上利用F可制得另一种化工产品,该反应的化学方程式为
(5)由K溶液经如何处理才能制得N?
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E是中学阶段常见的5种化合物,A、B是氧化物,元素X、Y的单质是生活中常见的金属,相关物质间的转化关系如图所示: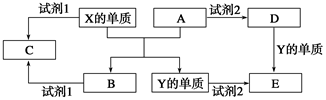
(1)X的单质与A反应的化学方程式是_______________________________。
(2)若试剂1是NaOH溶液,则X的单质与试剂1反应的离子方程式是
___________________________________
(3)若试剂1和试剂2均是稀硫酸。
①检验物质D的溶液中金属离子的方法是___________________________________。
②将物质C溶于水,其溶液呈酸性,原因是(用离子方程式表示)
________________________________________________。
③某高效净水剂是由Y(OH)SO4聚合得到的,工业上以E、稀硫酸和亚硝酸钠为原料制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C三种物质中均含有同一种元素,它们之间有如下图所示的转化关系(部分反应物已略去)。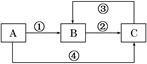
(1)若A是一种两性氧化物,B的水溶液呈酸性,请写出反应①和反应④(由A一步转化为B或C)的离子方程式:反应①______________________________________;
反应④_______________________________________________________。
(2)若反应①为置换反应,反应④为化合反应,C物质大量存在于海水中,是人体生理活动不可缺少的物质。工业上可以用C来制取A或B,请写出这两个反应的化学方程式:C→A________________________________________________________________________;
C→B_______________________________________________________________;
(3)若反应①②③均为化合反应,反应④为置换反应。当A为一种金属单质时,请写出反应②和③可能的离子方程式:②_____________________________________________;
③_____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铝广泛应用于化学工业和日常生活中。工业上由铝土矿(Al2O3·3H2O的含量约为85%,其余主要为SiO2、Fe2O3等)冶炼金属铝的流程如下。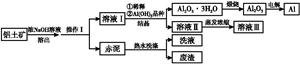
已知拜耳法生产Al2O3·3H2O的基本原理为:
Al2O3·3H2O+2NaOH(aq) 2NaAlO2(aq)+4H2O,[Al2O3·3H2O也可表示为2Al(OH)3]
2NaAlO2(aq)+4H2O,[Al2O3·3H2O也可表示为2Al(OH)3]
(1)操作Ⅰ的名称为 ,赤泥中除含有铝硅酸盐外,还含有的主要物质有 。
(2)为了提高铝土矿的溶出速率可采取的有效措施为 (任写三点)。
(3)用化学平衡理论解释稀释溶液Ⅰ有利于Al2O3·3H2O 结晶的原因 。
(4)为了析出Al2O3·3H2O,也可向溶液Ⅰ中通入过量CO2气体,写出生成Al2O3·3H2O的离子方程式: 。
(5)为了回收赤泥附着液带走的有用成分,工业上将用热水洗涤后的洗液用作溶液Ⅰ的稀释剂,请指出流程图中另一处类似的做法 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知A~G有如图所示的转化关系(部分生成物已略去),其中A、G为单质,D是能使湿润的红色石蕊试纸变蓝色的气体,E、F均能与NaOH溶液反应。
请回答下列问题:
(1)写出F的电子式:____________。
(2)①C溶液与D反应的离子方程式为________________________________________________________________________________________________________________________________________________;
②F溶液与NaOH溶液共热反应的化学方程式为________________________________________________________________________________________________________________________________________________。
(3)①请用离子方程式解释C溶液为何显酸性:________________________________________________________________________________________________________________________________________________,
②F溶液中离子浓度由大到小的顺序为________________________________________________________________________。
(4)将5.4 g A投入200 mL 2.0 mol/L某溶液中有G单质产生,且充分反应后有金属剩余,则该溶液可能是________(填代号)。
A.HNO3溶液 B.H2SO4溶液 C.NaOH溶液 D.HCl溶液
(5)将1 mol N2和3 mol G及催化剂充入容积为2 L的某密闭容器中进行反应,已知该反应为放热反应。平衡时,测得D的物质的量浓度为a mol/L。
①如果反应速率v(G)=1.2 mol/(L·min),则v(D)=________mol/(L·min)。
②在其他条件不变的情况下,若起始时充入0.5 mol N2和1.5 mol G达到平衡后,D的物质的量浓度________(填“大于”“小于”或“等于”) mol/L。
mol/L。
③该条件下的平衡常数为__________________(用含a的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有100 mL NaOH溶液,先向其中逐渐通入一定量的CO2,随后向此溶液中逐滴加入4 mol/L的盐酸溶液,产生的CO2气体体积(标准状况下)与所加入盐酸溶液的体积之间的关系如图所示,试求: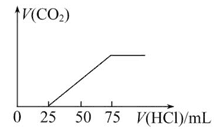
(1)NaOH在吸收CO2气体后,所得溶液中存在的溶质是:________,其物质的量是________。
(2)在加入盐酸情况下产生的CO2气体体积为(标准状况)________。
(3)原NaOH溶液的物质的量浓度是______________________________________;
若以Na2O2固体溶于水配得100 mL该溶液需Na2O2__________________________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com