
| ||
| ||


 Сѧ�������Ծ�ϵ�д�
Сѧ�������Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��̼���Ƶ�ˮ�⣺CO32-+2H2O?H2CO3+2OH- |
| B���ƺ�ˮ��Ӧ��Na+2H2O�TNa++2OH-+H2�� |
| C���ù���������ữ�����ҽ���Һ����ȡ�⣺2I-+H2O2�TI2+2OH- |
| D����NaAlO2��Һ��ͨ�����CO2��Al��OH��3��AlO2-+CO2+2H2O�TAl��OH��3��+HCO3- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
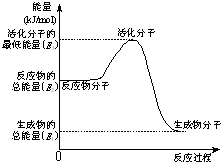 �״����ӽ���Ĥȼ�ϵ���н��״�����ת��Ϊ���������ַ�Ӧԭ����
�״����ӽ���Ĥȼ�ϵ���н��״�����ת��Ϊ���������ַ�Ӧԭ����| 1 |
| 2 |
| A������ͼʾ�ķ�ӦΪ���ȷ�Ӧ |
| B��ͼ�е������仯��ͼ��ʾ����Q=E3-E1 |
| C��H2ȼ���ܷų��������ȣ���CH3OHת���H2�Ĺ��̱����������� |
| D�����ݢ٢���֪����25�棬101kPaʱ��1mol CH3OH��g����ȫȼ������CO2��H2O�ų�������Ӧ676.7kJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ת���ļ״������ʵ��� |
| ���������ʵ��� |
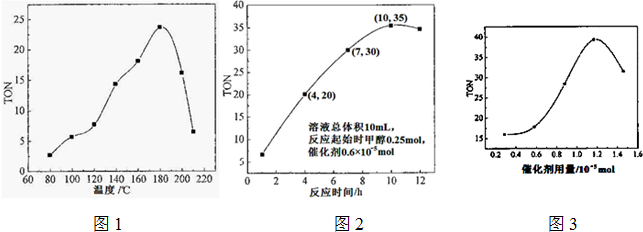
| H2CO3 |
| HCO3- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 �����£�N2H4���ǵ������ֳ����⻯��ڿ�ѧ����������������Ҫ��Ӧ�ã�
�����£�N2H4���ǵ������ֳ����⻯��ڿ�ѧ����������������Ҫ��Ӧ�ã�| T/�� | 165 | 175 | 185 | 195 |
| K | 111.9 | 7.1 | 50.6 | 3.8 |
| n(NH3) |
| n(CO2) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
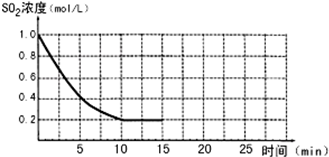 ��֪��2SO2��g��+O2��g��?2SO3��g������H=-196kJ/mol��850Kʱ����2L�̶��ݻ����ܱ������г���2mol SO2��2mol O2��10���Ӻ�ﵽƽ�⣬SO2Ũ�Ⱥ�ʱ���ϵ��ͼ��
��֪��2SO2��g��+O2��g��?2SO3��g������H=-196kJ/mol��850Kʱ����2L�̶��ݻ����ܱ������г���2mol SO2��2mol O2��10���Ӻ�ﵽƽ�⣬SO2Ũ�Ⱥ�ʱ���ϵ��ͼ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
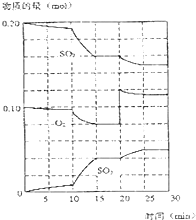 ��һ�������£�������̼�������������·�Ӧ��
��һ�������£�������̼�������������·�Ӧ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
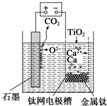 ��ͼ��ʯī������������������������CaF2-CaO������ʣ�ͼʾװ�ù���ʱ�����ɵĽ������ܻ�ԭ���������Ʊ������ѣ�����˵������ȷ���ǣ�������
��ͼ��ʯī������������������������CaF2-CaO������ʣ�ͼʾװ�ù���ʱ�����ɵĽ������ܻ�ԭ���������Ʊ������ѣ�����˵������ȷ���ǣ�������| A��������ӦʽΪC+2O2--4e-�TCO2�� |
| B����TiO2�Ƶ�1mol����Ti�����������·ת��4mol���� |
| C���Ʊ�������ǰ��װ����CaO�������� |
| D��TiO2�������ŵ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����ˮ�е����̪��Һ����Һ��죺NH3?H2O�TNH4++OH- |
| B��90��ʱ����ô�ˮ��c��H+��?c��OH-��=3.8��10-13��H2O��l��?H+��aq��+OH-��aq����H��0 |
| C��FeCl3��Һ��ͨ��SO2����Һ��ɫ��ȥ��2Fe3++SO2+2H2O�T2Fe2++SO42-+4H+ |
| D��������Һ��ͨ��CO2����Һ����ǣ�2C6H5ONa+CO2+H2O��2C6H5OH+Na2CO3 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com