
【题目】配制 100 mL 1.00 mol/L NaCl 溶液,下列说法正确的是( )
A.将所需量的 NaCl 溶于 100 mL 水中
B.将所需量的 NaCl 溶于少量水中,再加水定容到 100 mL
C.将所需量的 NaCl 直接放入容量瓶中,加水定容到 100 mL
D.定容时俯视读刻度
【答案】B
【解析】
根据题中配制100mL 1.00mol/L NaCl 溶液可知,本题考查一定物质的量浓度溶液的配置,根据![]() 和
和![]() 算出所需的氯化钠的质量,然后将所需要量的氯化钠,溶于水配成100ml溶液即可,注意100ml是指溶液的体积。
算出所需的氯化钠的质量,然后将所需要量的氯化钠,溶于水配成100ml溶液即可,注意100ml是指溶液的体积。
A.NaCl溶于100mL水中,溶液的体积大于100ml,所配溶液浓度偏小,故A错误;
B.根据浓度公式![]() ,将所需量的NaCl溶于少量水中,再加水定容到100mL,所得溶液的体积为100ml,所得溶液的浓度为1.00mol/L,故B正确;
,将所需量的NaCl溶于少量水中,再加水定容到100mL,所得溶液的体积为100ml,所得溶液的浓度为1.00mol/L,故B正确;
C.容量瓶为精密仪器,不能在容量瓶中稀释或者溶解物质,故C错误;
D.定容时应平视刻度线,如果俯视,则会导致加入的蒸馏水偏多,最终溶液的体积偏大,根据![]() 知最终配的溶液浓度偏小,故D错误;
知最终配的溶液浓度偏小,故D错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】已知 可简写为
可简写为![]() ,降冰片烯的分子结构可表示为:
,降冰片烯的分子结构可表示为:
(1)降冰片烯属于__________。
A.环烃 B.烷烃 C.不饱和烃 D.芳香烃
(2)降冰片烯的分子式为____________.
(3)降冰片烯的一种同分异构体(含有一个六元环的单环化合物)的结构简式为________.
(4)推断降冰片烯应该具有的性质是__________。
A.能溶于水 B.能使高锰酸钾溶液褪色
C.能与氢气发生加成反应 D.常温常压下为气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C为短周期元素,在周期表中所处的位置如图所示。A、C两元素的原子核外电子数之和等于B原子的电子数。B原子核内质子数和中子数相等。
![]()
(1)写出A、B、C三元素名称:________、________、________。
(2)C在元素周期表中的位置是________
(3)B的原子结构示意图为____,C的氢化物与B的氢化物的稳定性强弱顺序为___>___(填化学式)。
(4)比较A、C的原子半径:A________(填“>”或“<”)C,写出A的气态氢化物与A的最高价氧化物对应水化物反应的化学方程式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用可溶性钡盐检验 SO![]() 离子的存在时,先在待测溶液中加入盐酸,其作用是( )
离子的存在时,先在待测溶液中加入盐酸,其作用是( )
A.形成较多的白色沉淀
B.形成的沉淀纯度更高
C.排除 SO![]() 以外的其它阴离子及 Ag+的干扰
以外的其它阴离子及 Ag+的干扰
D.排除 Ba2+以外的其它阳离子的干扰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1.0 L恒容密闭容器中投入1 mol CO2和2.75 mol H2发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示。下列说法正确的是
CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示。下列说法正确的是

A. 该反应的正反应为放热反应
B. 压强大小关系:p1<p2<p3
C. M点对应的平衡常数K的值约为 1.04×10-2
D. 在p2及512 K时,图中N点v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,6-己二酸是合成高分子化合物尼龙的重要原料之一,可用六个碳原子的化合物氧化制备。如图是合成尼龙的反应流程:
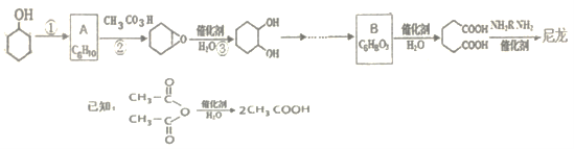
完成下列填空:
(1)写出反应类型:反应①_____反应②_______。
(2)A和B的结构简式为_______、_______。
(3)由![]() 合成尼龙的化学方程式为___。
合成尼龙的化学方程式为___。
(4)由A通过两步制备1,3-环己二烯的合成线路为:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PBAT(聚已二酸对苯二甲酸丁酯)可被微生物几乎完全降解,成为包装、医疗和农用薄膜等领域的新兴材料,它可由聚合物PBA和PBT共聚制得,一种合成路线如下:

已知: 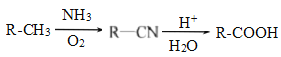
![]()
回答下列问题:
(1)G的官能团的名称为________。
(2)①的反应类型为___________;反应②所需的试剂和条件是___________。
(3)D的结构简式为___________;H的化学名称为___________。
(4)⑤的化学方程式为_______________________________________________。
(5)M与G互为同系物,M的相对分子质量比G大14;N是M的同分异构体,写出同时满足以下条件的N的结构简式:___________________(写两种,不考虑立体异构)。
Ⅰ、既能与FeCl3发生显色反应,又能发生水解反应和银镜反应;
Ⅱ、与NaOH溶液反应时,1mol N能消耗4molNaOH;
Ⅲ、核磁共振氢谱有五组峰,峰面积比为1:2:2:2:1。
(6)设计由丙烯为起始原料制备 的单体的合成路线(其它试剂可任选)________________________________________________________________。
的单体的合成路线(其它试剂可任选)________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2L的密闭容器中,X、Y、Z三种物质随时间变化的曲线如图所示。
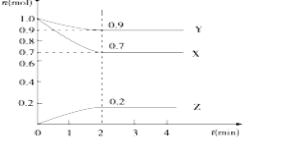
请回答下列问题:
(1)由图中数据分析,该反应的化学方程式为__。
(2)反应开始至2min,Z的平均反应速率为__(列式计算,写出计算过程。)
(3)3min时,Z的生成速率与Z的消耗速率相比较,前者__(填“大于”“小于”或“等于”)后者。
(4)上述反应进行过程中,如果降低温度,则其反应速率___(填“增大”“减小”或“不变”)。
(5)下列各项中不可以说明上述反应达到平衡的是__(填字母)
a.混合气体的密度不变
b.混合气体的压强不变
c.同一物质的正反应速率等于逆反应速率
d.X的浓度保持不变
e.生成1molZ和同时生成1.5molX
f.X、Y、Z的反应速率之比为3:2:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com