
(10分)如图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B、C、D、E是非金属单质,且在常温常压下都是气体;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;反应①是化工生产中的一种重要的固氮反应。
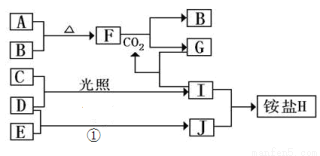
(1)单质E的结构式_____________
(2)F和H2O反应的化学方程式为_____________________________,该反应中被氧化与被还原的物质的物质的量之比是_________________
(3)铵盐H中阳离子的电子式_______________,检验H 中阳离子的方法是____________________
_____________________________________________________________________________
(1)N≡N
(2)2Na2O2+2H2O=4NaOH+O2↑ ; 1:1
(3)  ;取少量H样品放入试管中,加入NaOH溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明含有NH4+
;取少量H样品放入试管中,加入NaOH溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明含有NH4+
【解析】
试题分析:化合物G的焰色反应为黄色,含有Na元素,F能与二氧化碳反应得到气体单质B与G,可推知F为Na2O2,B为O2,G为Na2CO3,而A与B(氧气)反应得到F(过氧化钠),则A为Na.G(Na2CO3)与I反应得到CO2,则I属于酸,I由气体非金属单质C与D在光照条件下得到,则I为HCl,C、D分别为H2、Cl2中的一种,I和J通常状况下呈气态,二者反应得到铵盐,且反应①是化工生产中的一种重要固氮反应,可推知J为NH3,D为H2,E为N2,铵盐H为NH4Cl,故C为Cl2;
(1)单质E为N2,分子中N原子之间形成3对共用电子对,其结构式为N≡N;
(2)F为过氧化钠,与H2O反应生成氢氧化钠与氧气,化学方程式为2Na2O2+2H2O=4NaOH+O2↑,该反应中被氧化与被还原的物质都是过氧化钠,由电子转移守恒可知,被氧化与被还原过氧化钠的物质的量之比是1:1;
(3)铵盐H为NH4Cl,NH4+离子的电子式为 ,检验NH4+离子的方法是:取少量H 样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子。
,检验NH4+离子的方法是:取少量H 样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子。
考点:考查无机物推断、电子式、结构式书写、离子检验等相关知识。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2013-2014湖南师大附中第二学期期中考试高二化学试卷(解析版) 题型:选择题
卤代烃的取代反应,实质是带负电荷的原子团取代了卤代烃中的卤原子,如CH3Br+OH-(或NaOH)―→CH3OH+Br-(或NaBr),下列反应的化学方程式中,不正确的是
A.CH3CH2Br+NaHS―→CH3CH2SH+NaBr
B.CH3I+CH3ONa―→CH3OCH3+NaI
C.CH3CH2Cl+CH3ONa―→CH3CH2ONa+CH3Cl
D.CH3CH2Cl+CH3CH2ONa―→(CH3CH2)2O+NaCl
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省黄石市秋季高二化学期中统考试卷(解析版) 题型:选择题
下图甲池和乙池中的四个电极都是惰性材料,乙池溶液分层,上层溶液为盐溶液,呈中性。请根据图示判断下列有关说法不正确的是( )

A.甲池是原电池、乙池是电解池
B.通入乙醇的惰性电极的电极反应式为:C2H5OH+16OH--12e-=2CO32-+11H2O
C.反应一段时间后,两池溶液的pH均未变化
D.假如乙池中加入NaI溶液,则在乙池反应过程中,可以观察到C电极周围的溶液呈现棕黄色,反应完毕后,用玻璃棒搅拌溶液,则下层溶液呈现紫红色,上层接近无色
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省高三5月模拟考试理综化学试卷(解析版) 题型:填空题
(14分)(1)NO2有较强的氧化性,能将SO2氧化生成SO3,本身被还原为NO,已知下列两反应过程中能量变化如图所示:

则NO2氧化SO2的热化学方程式为_________________________________。
(2)在2L密闭容器中放入1mol氨气,在一定温度进行如下反应:2NH3(g) N2(g)+3H2(g),
N2(g)+3H2(g),
反应时间(t)与容器内气体总压强(p)的数据见下表
时间t/min | 0 | 1 | 2 | 3 | 4 | 5 |
总压强p 100 kPa | 5 | 5.6 | 6.4 | 6.8 | 7 | 7 |
则平衡时氨气的转化率为___________。
(3)25℃,某二元弱酸H2A与NaOH溶液反应可生成NaHA、Na2A,溶液中含A各微粒的分布分数(平衡时某含A微粒的浓度占各含A微粒浓度之和的分数)随溶液变化的情况如下图所示:
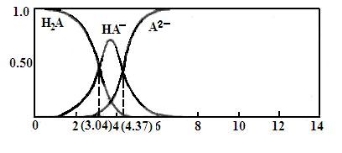
已知:103.04=1.1×103,104.37=2.3×104 25℃,Ka1(H2CO3)= 4.4×10-7 Ka2(H2CO3) = 4.7×10-11
①若向0.1NaHAmol·L-1溶液中加入少量NaOH溶液,c(A2-)/c(HA-)的值 (填“增大”、“减小”或“不变”,下同),c(H+)/c(OH-) 的值 。
②若向0.1NaHAmol·L-1溶液中加入氨水至溶液呈中性,则c(H2A)+c(NH4+) c(A2-) (填“大于”、“小于”或“等于”)。
③计算HA-二级电离平衡常数Ka2= 。
④将过量H2A加入Na2CO3溶液中反应的离子方程式为: 。
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省高三5月模拟考试理综化学试卷(解析版) 题型:选择题
下列与化学有关的说法正确的是
A.富含氮、磷的生活污水不能排放到河中,但可以直接用于农田的灌溉
B.高温加热氧化镁和碳的混合物可以制得单质镁
C.白酒标签上注有“酒精浓度53%VO1”字样,它表示100g该白酒中含有53g酒精
D.瓷坩埚能耐高温,可以用于加热分解石灰石
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省高一下学期期中联考化学试卷(解析版) 题型:选择题
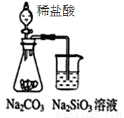
关于下列图示的说法正确的是
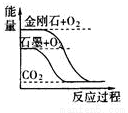
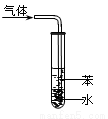
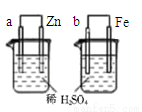

A.图①表示石墨转变为金刚石是吸热反应
B.图②所示实验可比较非金属性强弱:氯﹥碳﹥硅
C.图③吸收NH3并防倒吸
D.图④两装置中金属电极a、b都有气体产生,可判断金属活动性:a﹤b
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省高一下学期期中联考化学试卷(解析版) 题型:选择题
对于反应A(g)+3B(g)  2C(g),下列各数据表示同一反应速率是
2C(g),下列各数据表示同一反应速率是
①v(A)=0. 10 mol/(L? min) ②v(B)=0. 20 mol/(L? min)
③v(B)=0.30mol/(L?min) ④v(C)=1.00mol/(L?min)
A.①② B.①③ C.③④ D.②④
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省武汉市高三四月调考理综化学试卷(解析版) 题型:选择题
下列说法不正确的是:
A.通过煤的干馏可获得苯、甲苯等芳香烃
B.在海轮外壳装上锌块,可减缓船体的腐蚀速率
C.电渗析法、离子交换法中,只有后者可以应用于海水的淡化
D.我国城市推广使用清洁燃料是压缩天然气类和液化石油气类
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省大冶市春季期末考试高二化学试卷(解析版) 题型:实验题
(12分)苯甲酸甲酯是一种重要的工业原料,某化学小组采用如下图装置,以苯甲酸、甲醇为原料制取苯甲酸甲酯。有关物质的物理性质见下表所示:

| 苯甲酸 | 甲醇 | 苯甲酸甲酯 |
熔点/℃ | 122.4 | -97 | -12.3 |
沸点/℃ | 249 | 64.3 | 199.6 |
密度/g.cm-3 | 1.2659 | 0.792 | 1.0888 |
水溶性 | 微溶 | 互溶 | 不溶 |
Ⅰ.合成苯甲酸甲酯粗产品在圆底烧瓶中加入0.1mol苯甲酸和0.4mol 甲醇,再小心加入 3mL浓硫酸,混匀后,投入几粒沸石,小心加热使反应完全,得苯甲酸甲酯粗产品。
(1)甲装置的作用是: ;冷却水从 (填“a”或“b”)口进入。
(2)化学小组在实验中用过量的反应物甲醇,其理由是 。
Ⅱ.粗产品的精制
苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程进行精制

(1)试剂1可以是 (填编号),作用是 。
A.稀硫酸 B.碳酸钠溶液 C. 乙醇
(2)操作2中,收集产品时,控制的温度应在 ℃左右。
(3)实验制得的苯甲酸甲酯精品质量为10g,则苯甲酸的转化率为 (结果保留三位有效数字)。
(4)本实验制得的苯甲酸甲酯的产量低于理论产量,可能的原因是 (填编号)。
A.蒸馏时从100℃开始收集产品 B.甲醇用量多了 C.制备粗品时苯甲酸被蒸出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com